Actualités sur les médicaments dérivés du sang

Revue
Actualités sur les médicaments
dérivés du sang
Current status of fractionated plasma products
Thierry Burnouf
Human Plasma Product Services
(HPPS),
18 rue Saint-Jacques,
59800 Lille
Résumé.
La vingtaine de médicaments protéiques dérivés du plasma humain – au
nombre desquels se trouvent diverses fractions coagulantes, comme le facteur VIII, et
les immunoglobulines G – exercent une fonction thérapeutique essentielle, en
particulier dans le traitement substitutif de troubles hémorragiques ou immunologi-
ques. Ces produits sont obtenus par le fractionnement industriel de lots de plusieurs
milliers de litres de plasma. Les procédures de fractionnement modernes combinent
généralement les techniques traditionnelles de précipitation et les méthodes plus
fines de chromatographie. Le niveau de pureté et de qualité de ces produits s’est
considérablement accru. Par leur origine humaine, ces produits sont une source
possible de transmission d’agents pathogènes. Toutefois, la marge de sécurité virale
des médicaments dérivés du sang n’a cessé de progresser au cours de ces
15 dernières années grâce, en premier lieu, à la maîtrise industrielle de procédés
d’inactivation et d’élimination virales, mais aussi à l’affinement des méthodes de
contrôle du plasma, particulièrement le dépistage génomique viral (DGV), et à la
rigueur des critères de sélection des donneurs. Ainsi, il n’y a pas eu de cas de
transmission de SIDA, ou d’hépatites B ou C par ces médicaments depuis près de
15 ans. La transfusion de concentrés globulaires s’est avérée être récemment, au
Royaume-Uni, la cause vraisemblable de 4 cas de transmission du prion induisant la
variante de la maladie de Creutzfeldt-Jakob (vMCJ). On n’a recensé toutefois à ce
jour aucun cas de transmission de vMCJ par les produits plasmatiques, vraisembla-
blement parce que les procédés de fractionnement ont, expérimentations à l’appui,
la capacité d’éliminer les doses infectieuses présumées faibles de l’agent infectieux
éventuellement présent dans le plasma. Cependant, la prudence reste de mise tant
que la nature du prion dans le sang ne sera pas pleinement élucidée. Dans un
contexte d’encadrement réglementaire très strict, le profil des médicaments dérivés
du sang répond aujourd’hui aux exigences de qualité les plus élevées requises pour
l’utilisation en thérapeutique humaine. Du fait de l’origine humaine, une vigilance
constante vis-à-vis de risques infectieux émergents est de mise.
Mots clés : médicaments, sang, plasma, virus, inactivation, prion
Abstract.A range of about 20 medicinal protein products can be extracted from
human plasma. Among those are various coagulation factor concentrates, such as
factor VIII, and immunoglobulins preparations that are essential as replacement
therapy of bleeding and immunological disorders. These products are obtained by
the industrial fractionation process of batches of several thousands liters of plasma.
The current plasma fractionation technology combines the traditional cold ethanol
precipitation process with more specific chromatographic methods. The purity and
quality profile of these products has improved dramatically in the last few years.
Due to their human origin, these products can potentially transmit pathogenic
agents. However, the margin of safety against the risk of viral transmission has
improved in the last 15 years thanks to (a) the use of efficient industrial viral
inactivation and removal procedures, (b) the increasingly refined viral screening
tests performed of the plasma raw material, most specifically by nucleic acid
Tirés à part :
T. Burnouf
Hématologie 2008 ; 14 (1) : 36-47
Hématologie, vol. 14, n° 1, janvier-février 2008
36
doi: 10.1684/hma.2008.0200
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

testing, and (c) the increasingly selective criteria prevailing for donor screening.
There has been no transmission of AIDS, hepatitis B, nor hepatitis C by licensed
plasma products in the last 15 years. Recently, four cases of transmission of variant
Creutzfeldt-Jakob disease (vCJD) have been identified and ascribed to the infusion
of non leucoreduced red blood cell concentrates from donors who subsequently
developed the disease. However, to date, no case of transmission of prions by
plasma products have been observed, possibly because, as demonstrated by
experimental validation studies, several fractionation steps have the capacity to
remove the presumably low infectivity present in the plasma. Therefore, the risk of
transmission of vCJD by human plasma products appears very remote, but caution
should prevail since the biochemical nature of the infectious agent in human blood
is still unknown. Under current regulations, licensed fractionated plasma products
are among the safest therapeutic biological products available. Still, constant
vigilance against emerging human pathogenic agents is in place.
Key words: plasma products, blood, virus, inactivation, prion
Le plasma humain contient un nombre important
de protéines qui se révèlent essentielles à la
régulation et à l’équilibre des processus physio-
logiques de l’organisme. La fonction de certai-
nes de ces protéines est apparue clairement
quand un lien de cause à effet a été établi entre l’existence
d’un déficit congénital ou acquis et la survenue d’une patho-
logie. Parmi les plusieurs centaines de protéines identifiées
dans le plasma, plus d’une vingtaine sont aujourd’hui extrai-
tes industriellement et utilisées comme médicament, en parti-
culier à titre de thérapeutique substitutive consistant à restau-
rer chez le malade un taux circulant plasmatique normal.
La figure 1 est une représentation de la composition pro-
téique du plasma humain ; elle illustre la diversité tant qualita-
tive que quantitative du plasma, mais aussi le défi technologi-
que présenté par l’extraction de certaines de ces protéines
présentes à l’état de traces.
Au fil des 15 dernières années, le fractionnement plasmati-
que a poursuivi sa mutation et son évolution, tout particulière-
ment pour assurer au mieux la sécurité virale et, plus globale-
ment, la qualité des produits [1]. Aujourd’hui, il s’inscrit, sans
conteste, parmi les disciplines les plus avancées et les plus
exigeantes de l’industrie biopharmaceutique. Cet article fait
le point sur le mode de production et sur les caractéristiques
de ces produits essentiels, de même que sur l’état des
connaissances et sur les progrès accomplis dans la maîtrise
des risques de transmission de virus et de prions.
Fractionnement plasmatique
Situation mondiale
Le processus industriel complexe permettant l’extraction des
produits plasmatiques est appelé « fractionnement plasmati-
que ». Le volume de plasma fractionné se monte à environ 25
millions de litres à l’échelle mondiale, dont environ 600 000
litres en France. Les phases d’extraction des protéines sont
réalisées à grande échelle dans des usines de haute technolo-
gie dénommées « centres de fractionnement ». On dénom-
bre environ 70 centres dans le monde, dont 3 en France, 2
d’entre eux étant localisés aux Ulis et à Lille et regroupés au
sein du Laboratoire français du fractionnement et des biotech-
nologies (LFB).
La plupart des centres de fractionnement se trouvent dans des
pays industrialisés ou émergents [2]. Dans l’Union euro-
péenne, on trouve des centres de fractionnement en Allema-
gne, en Angleterre, en Autriche, en Belgique, en Espagne, en
Hollande, en Hongrie, en Italie, et en Suède. Ailleurs, des
centres de fractionnement existent en Australie, en Chine,
aux Etats-Unis, au Japon, et en Suisse. Le Brésil, l’Iran, la
Russie et l’Inde envisagent la construction d’un centre de
fractionnement afin de subvenir au moins partiellement à
leurs besoins en produits plasmatiques. L’insuffisance de
production et le coût conduisent à une disparité marquée
dans l’usage clinique de ces produits entre le monde indus-
trialisé et les pays en voie de développement.
Collecte du plasma pour fractionnement
Le plasma pour fractionnement peut être préparé soit à partir
de dons de sang total (cas majoritaire en France), soit à partir
de dons de plasma par aphérèse (procédure utilisée majori-
tairement aux Etats-Unis pour la collecte auprès de donneurs
rémunérés). Dans le cas d’une collecte de sang total, le don
doit subir une ou plusieurs étapes de centrifugation afin de
séparer le plasma des composants cellulaires (tout particuliè-
rement les globules rouges). Les centres de collecte sont soit
sous le contrôle direct des fractionneurs (c’est le cas par
exemple de centres de plasmaphérèse localisés aux Etats-
Unis), soit d’établissements de transfusion (comme en France)
qui ont des contrats de fourniture de plasma avec le fraction-
neur. Dans tous les cas de figure, la collecte et la préparation
du plasma pour fractionnement font l’objet d’un cadre régle-
mentaire très strict, sous le contrôle des autorités nationales
de santé. Des critères particuliers sont appliqués pour la
préparation de plasmas « spécifiques » (hyper-immuns) ren-
fermant un titre élevé en anticorps neutralisants dirigés contre
Hématologie, vol. 14, n° 1, janvier-février 2008
37
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

des antigènes sanguins (facteur rhésus ou antigène D) ou des
agents infectieux (par exemple le virus de l’hépatite B) [3]. Le
plasma pour fractionnement doit de préférence être congelé
rapidement (dans la pratique, généralement à - 30 °C) dans
les 24 heures, et mieux dans les 8 heures après la collecte
afin de bien préserver les facteurs de la coagulation, dont le
facteur VIII. La chaîne du froid, en particulier lors du transport
chez le fractionneur, doit être assurée.
Technologies de fractionnement
La méthodologie de fractionnement utilisée de nos jours
s’inspire encore beaucoup du procédé historique débutant
par la cryoprécipitation, qui est une décongélation du
plasma à basse température pour isoler le cryoprécipité
enrichi en facteur VIII, en facteur Willebrand et en fibrino-
gène. Les protéines de la fraction surnageante (surnageant
de cryoprécipité) sont séparées par précipitations séquentiel-
les en présence d’éthanol, tel que mis au point par les équipe
de Cohn [4], puis de Kistler and Nitschman [5]. Le degré de
complexité des procédés de fractionnement s’est accru au fur
et à mesure que de nouveaux produits ont été développés à
partir des différentes fractions issues de cette méthodologie
de base. Le fractionnement plasmatique moderne s’est donc
adjoint des procédés de purification chromatographiques
qui permettent l’isolement de nouveaux produits (facteurs de
coagulation, anticoagulants, inhibiteurs de protéase) à des
niveaux de pureté élevés.
Dans la pratique, le fractionnement plasmatique s’opère
généralement de la manière suivante. La taille des lots de
fractionnement est de l’ordre de 2 000 à 4 000 L, soit
environ 10 000 dons. Les poches de plasma congelé sont
découpées dans des conditions hygiéniques strictes. Les
plasmas sont mélangés pour l’étape de cryoprécipitation
industrielle réalisée à 1- 4 °C. Le cryoprécipité est recueilli et
généralement recongelé en attente de transformation ulté-
rieure. Le surnageant de cryoprécipité est traité immédiate-
ment par chromatographie d’échange d’anions pour l’extrac-
tion des composants du complexe prothrombique (les
facteurs de la coagulation vitamino-K dépendants II, VII, IX, et
X, de même que les protéines anticoagulantes C et S).
La fraction plasmatique non adsorbée peut être soumise à
une chromatographie d’affinité sur gel d’héparine immobili-
sée pour fixer l’antithrombine ou sur un échangeur d’anions
pour la capture d’une fraction enrichie en inhibiteur de la
C1-estérase (C1-inhibiteur). Le plasma non adsorbé est
ensuite soumis aux étapes de fractionnement à l’éthanol à
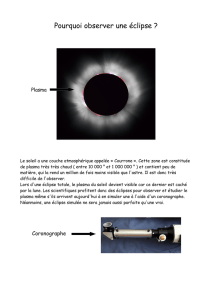
Albumine
64,25 %
Alpha-2 macro
4,40 %
Fibrinogène
5,07 %
IgG
20,29 %
Alpha-1 AT
2,54 %
FVIII
< 0,00 %
Prothrombine
0,25 %
FVII
< 0,00 %
PC
0,01 %
vWF
0,02 %
C1-inhibiteur
0,29 %
Autres
1,69 %
Fibronectine
0,51 %
Antithrombine
0,34 %
Plasminogène
0,34 %
FXI
0,01 %
FIX
0,01 %
g
Figure 1. Composition schématique du plasma humain révélant sa diversité tant qualitative que quantitative en protéines. L’albumine,
protéine majoritaire, est présente à une concentration de l’ordre de 40 g/L tandis que certains facteurs de coagulation représentent moins
de 1 mg/L.
Hématologie, vol. 14, n° 1, janvier-février 2008
38
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

des concentrations comprises entre 8 et 40 % et dans des
conditions de pH, de température et d’osmolalité définies. Les
précipités obtenus sont séparés, par centrifugation ou filtra-
tion, et permettent l’isolement de fractions enrichies en fibri-
nogène, en immunoglobulines G, en alpha-1 antitrypsine ou
en albumine. Selon les procédés, ces fractions sont purifiées
par des étapes complémentaires de précipitation éthanoli-
ques ou par chromatographie. Un exemple de procédé de
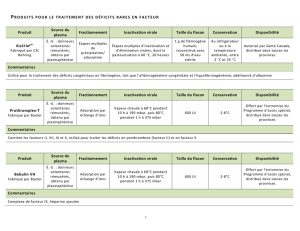
fractionnement est reproduit en figure 2.
Sécurisation virale
Agents pathogènes
Divers agents infectieux pathogènes peuvent être présents
dans le sang [3, 6, 7]. Les agents bactériens et parasitaires,
de même que les virus strictement intracellulaires, ne créent
pas de risque infectieux pour les produits plasmatiques, en
particulier du fait de leur destruction lors de la congélation du
plasma et de leur élimination par les nombreuses étapes de
filtration (jusqu’à 0,2 lm) réalisées au cours de fractionne-
ment. Le cas spécifique des prions est abordé plus loin.
Les caractéristiques des virus pathogènes transmissibles par
les produits sanguins et les médicaments dérivés du plasma
sont rappelées dans le tableau 1. Les virus les plus pathogè-
nes transmissibles par les produits plasmatiques (en
l’absence de traitements d’inactivation virale) sont le virus de
l’immunodéficience acquise (VIH) et les virus des hépatites B
et C, tous munis d’une enveloppe lipidique. Les virus de
l’hépatite A et le parvovirus B19, non enveloppés, peuvent
aussi être transmis par certains produits (en particulier les
fractions coagulantes) [1, 8]. Divers virus émergents envelop-
pés (dont le virus du Nil Occidental) peuvent être présents
dans le plasma, mais les procédures actuelles de fabrication
des médicaments dérivés du sang (en particulier les traite-
ments de réduction virale) paraissent éviter les risques de
transmission [9]. Les virus leucotropes, notamment des virus
de la famille des Herpesviridae (cytomégalovirus, virus d’Eps-
tein Barr [EBV], virus herpès humain 8 [VHH-8]) et le virus
HTLV (Human T cell Leukemia/lymphoma Virus) sont transmis-
sibles par les produits labiles cellulaires, mais non par les
produits plasmatiques.
Une panoplie de moyens, résumée dans le tableau 2 et
développée ci-dessous, a été mise en place pour assurer un
degré maximum de sécurité virale des médicaments dérivés
du sang. Celle-ci s’articule à trois niveaux :
– réduction maximale de la charge virale dans le lot de
plasma pour fractionnement par des procédures de sélection
Tableau 1
Caractéristiques et risques de transmission avérés
(en l’absence de traitements d’inactivation virale) de virus potentiellement présents dans le sang humain
Virus Famille Génome Enveloppe Taille
(nm) Risques de transmission théorique
Produits
cellulaires
non viro-
inactivés
Plasma pour
transfusion
non viro-
inactivé
Médicaments
dérivés du
plasma
1
Epstein-Barr Herpès ADN db E 120-220 + - -
Cytomegalo Herpès ADN db E 180-200 + - -
Herpès humain 8 Herpès ADN db E 120-200 + - -
Immunodéficience humaine Rétro ARN sb E 80-100 + + (+)
Human T cell Leukemia I & II Rétro ARN sb E 80-100 + - -
Simian foamy Rétro ARN sb E 80-100 ? ? (-)
SRAS Corona ARN sb E 60-220 - ? (-)
Nil occidental Flavi ARN sb E 40-60 + ? (-)
Hépatite G Flavi ARN sb E 40-60 + + (+)
Hépatite C Flavi ARN sb E 40-50 + + (+)
Dengue Flavi ARN sb E 40-50 + ? (-)
TT Circo ADN sb E 30-50 + + (+)
Hépatite B Hépadna ADN db E 40-48 + + (+)
Hépatite E Hépe ARN sb NE 35-39 + + (+)
Hépatite Delta Delta ARN sb E 36 + + (+)
Hépatite A Picorna ARN sb NE 27-32 + + (+)
Parvovirus B19 Parvo ADN sb NE 18-26 + + (+)
1
La mise en place depuis près de 20 ans de traitements industriels de réduction virale a évité les risques de transmission de nombreux virus émergents parles
médicaments du sang.
E : enveloppé ; NE : non enveloppé ; + : cas documentés de transmission ; - : absence de transmission;?:risques de transmission incertains ou inconnus ; (+) :
risques de transmission connus ou vraisemblables en l’absence de procédures de réduction virale ; (-) : transmission virale vraisemblablement évitée grâce aux
procédés de réduction virale déjà en place ; sb : simple brin ; db : double brin.
Hématologie, vol. 14, n° 1, janvier-février 2008
39
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

FVII
Eluat CEI
CEI
Albumine
Fraction V
Fraction IV
Supernageant (I+) II+III
CEI
Cryoprécipité
Précipitation/adsorption
Inactivation virale
(Nanofiltration)
CEI
CIA + CEI
CES
Héparine immobilisée
Inactivation virale
CES
(Nanofiltration)
Alpha-1 antitrypsine
Cryoprécipitation
Précipitation (I+) II + III
Héparine immobilisée
(CEI)
(Fraction I)
Mélange plasmatique industriel
Surnageant de cryoprécipité
(Chauffage à sec)
Pasteurisation
IgG IM/IV
Nanofiltration
Inactivation virale
Précipité II
Précipitation III
Précipité (I+) II+III
Inactivation virale
CEI
(Nanofiltration)
PPSB
Protéine C
Héparine immobilisée ou CIA
Nanofiltration
FIX
(Chauffage à sec)
(Fib)
Antithrombine
(Fib)
Inactivation virale
(FvW) (Fib)FVIII
Figure 2. Schéma de fractionnement industriel du plasma humain pour la fabrication des médicaments dérivés du sang (d’après [15]).
Fib : fibrinogène ; FvW : facteur von Willebrand ; FVIII : facteur VIII ; FIX : facteur IX ; FVII : facteur VII ; PPSB : complexe prothrombique ; CEI : chromatographie d’échange d’ions ;
CES : chromatographie d’exclusion stérique ; CIA : chromatographie d’immuno-affinité ; () : étape optionnelle.
Hématologie, vol. 14, n° 1, janvier-février 2008
40
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%