DS6 1213

EXERCICE DE SPÉCIALITÉ
Protection des métaux contre la corrosion
Document 1.
bloc de zinc soudé sur la coque d'un bateau
Document 2 : Corrosion galvanique.
La corrosion galvanique est due à la différence de potentiel
qui apparaît entre deux métaux en contact électrique (direct
ou indirect) plongés dans un électrolyte (comme l'eau de
mer).
Une pile électrique est ainsi formée : les électrons quittent
le métal au potentiel le plus faible (anode) pour se diriger
au travers des métaux en contact vers celui au potentiel le
plus élevé (cathode).
Document 3 Test de différents ions
Ions à tester Réactif Résultat pour test positif
ion fer (II) Fe2+ ion hexacyanoferrate (III) précipité bleu
ion zinc (II) Zn2+ ion hexacyanoferrate (III) précipité blanc
ion hydroxyde HO- phénolphtaléine coloration rose
Document 4 : Trois expériences ont été menées :
expérience 1 expérience 2 expérience 3
On a plongé un clou en acier dans une
solution d'eau salée contenant également de
l'hexacyanoferrate (III) de potassium et de la
phénolphtaléine qui s'est gélifié par la suite...
Expérience 1 :
Le clou est plongé seul : on observe que la tête
et la pointe du clou sont entourées d'une zone
bleue alors que le corps est entouré d'une zone
rose.
Expérience 2:
Le clou est entouré d'un fil de cuivre : on
observe que le cuivre est entouré d'une zone
rose alors que le clou est entouré d'une zone
bleue
Expérience 3:
Le clou est en contact avec un morceau de
zinc : on observe que le clou est entouré d'une
zone rose alors que le zinc est entouré d'une
zone blanche.
DS6_1213.odt Page 1 sur 2 TS-SPE-JFC
Métal M1. Métal M2.
ion M
1
n
+
O
2
H
2
O

oxydant potentiel réducteur Documents 5 : métaux nobles
Un métal qui ne s'oxyde pas spontanément à l'air est dit "noble". Cette notion
est directement liée au potentiel d'oxydoréduction du couple oxyde/métal :
plus le potentiel est élevé, plus le métal est "noble". Ceci intervient
également dans la corrosion galvanique : le métal le moins noble se corrode
alors que le métal le plus noble est protégé.
Certains métaux considérés comme inoxydables sont en fait protégés par une
couche d'oxyde compacte adhérente et surtout étanche à l'oxydant, comme
par exemple l'aluminium et le titane : ils ne sont pas nobles, mais leur
corrosion est très lente car les oxydes d'aluminium et de titane sont étanches
à l'oxygène.
On peut donc classer les métaux du plus noble au moins noble :
Au > Ag > Cu > Pb > Sn > Ni > Cd > Fe > Cr > Zn > Al > Ti > Mg
Au++ 1,69 Au
O2 + 0,41 OH-
Cu2+ +0,34 Cu
H3O+0,00 H2 (g)
Pb2+ - 0,13 Pb
Sn2+ - 0,13 Sn
Ni2+ - 0,25 Ni
Cd2+ - 0,40 Cd
Fe2+ - 0,44 Fe
Cr3+ - 0,74 Cr
Zn2+ - 0,76 Zn
Document 6 :
descriptif (catalogue) de tôle ondulée
Galvanisée revêtue
Les tôles galvanisées sont fabriquées à partir d'un acier
de qualité supérieure galvanisé à chaud.
Acier de base : FEP026 selon EN1 0142:1991
Finition de surface : Fleurage brillant
Applications typiques
La tôle ondulée Hadley s’applique à de nombreux
domaines, de la construction de hangars polyvalents
et de stockage à la construction de bâtiments
spécifiquement conçus. La qualité de fabrication et la
gamme de dimensions de tôle assure une utilisation
économique et une durée de vie plus longue dans les
environnements les plus exigeants.
Questions
Observation des expériences.
Expérience 1 : écrire les demi-équations électroniques qui ont lieu dans les différents parties du clou en justifiant
la réponse ; peut-on considérer que le fer est oxydé ?
Expérience 3 :écrire les demi-équations électroniques qui ont lieu dans les différents parties du clou en justifiant la
réponse ; peut-on considérer que le fer est oxydé ?
Modélisation des expériences.
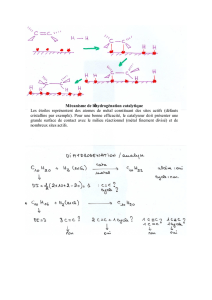
Expérience 2 et expérience 3 :
Proposer un schéma électrique (en s'inspirant du document 2) pour chacune des deux expériences en explicitant les
demi-réactions électroniques mises en jeu à chaque borne de la pile, le sens de circulation des électrons dans les
métaux et le sens de circulation des ions (Na+ et Cl- principalement) dans l'électrolyte ; identifier clairement
l'anode et la cathode de la pile.
Dans quel cas le fer est il protégé ?
Ordres de grandeur des courants galvaniques.
Un bloc de zinc d'une masse m = 10 g fixé sur la coque d'un bateau a complètement disparu après une période
d'utilisation de 10 ans. Calculer l'ordre de grandeur de l'intensité du courant galvanique circulant dans la pile.
Masse molaire du zinc : M = 65,4 g / mol
Nombre d'Avogadro : NA = 6,02 × 10 23 mol-1 Charge de l'électron : e = 1,60 × 10 -19 C
Rappel : l'intensité du courant électrique mesure le débit de charge électrique dans un conducteur : i = Δq / Δt
Protection des métaux.
Votre oncle veut changer la toiture de son garage ; il a décidé de poser un toit en tôle ondulée en acier galvanisé. Il
hésite sur la nature des fixations : clous en fer, ou clous en cuivre (comme sur les toitures en ardoise), ou vis en
acier galvanisé.
Rédigez un courrier argumenté dans lequel vous lui expliquez les avantages et les inconvénients des trois modes de
fixation.
DS6_1213.odt Page 2 sur 2 TS-SPE-JFC
1
/
2
100%