Virologie Médicale 1 Virus de la poliomyélite

Virologie Médicale 1
Virus de la poliomyélite
Les Picornaviridae
Enterovirus
Rhinovirus
Cardiovirus
Aphtovirus
Parechovirus
Hepatovirus
Teschovirus
Erbovirus
Kobuvirus
Poliovirus
Coxsakievirus A, B
Rhinovirus humain
Virus de l’encéphalomyocardite
Virus de Theiler murin
Virus de la fièvre aphteuse
Echovirus (EV22, 23)
Virus de l’hépatite A
Teschovirus porcin
Virus B de la rhinite équine
Aichi virus
Gastro-entérites, poliomyélite
Myocardite, pancréatite, méningite
Rhume (rhinite)
Encéphalite, cardite
Encéphalite
Eruptions vésiculeuses
Gastro-entérite, infection respiratoire
Hépatite A
Encéphalite
Affection respiratoire
Gastro-entérite
EspècesGenres Pathogénie

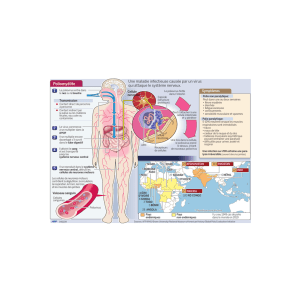
Bas relief égyptien (2000 ans avant JC )
La poliomyélite est une maladie ancienne
Répartition mondiale du poliovirus en 1988
Région où la transmission du
poliovirus est avérée ou probable
Données OMS

Répartition mondiale du poliovirus en 1999
(après campagne de vaccination)
Transmission probable du poliovirus (8 pays)
Transmission du poliovirus (22 pays)
Cas d’importation du poliovirus (3 pays) Données OMS
Transmission fécale-orale des Enterovirus
Manquement
aux règles
d’hygiène
Mains sales
Légumes
Eau de consommation
Fruits de mer
Voyages en pays d’endémie
Contamination fécale
de l’environnement
L’eau de javel efficace
pour inactiver ces virus
Figure extraite du traité
de Virologie Médicale
Édition ESTEM

Phase digestive Phase lymphatique Phase virémique Phase neuronale
Pathogenèse de la poliomyélite
Infection par le poliovirus
Poliomyélite non paralysante avec des spasmes
musculaires et un mal de dos (durée 2 à 10 jours)
Elle concerne 1 à 2% des sujets infectés
Pas de symptôme apparent chez 90 à 95% des individus
Période d'incubation de la maladie de 7 à 14 jours
Infection bénigne de quelques jours avec des signes
pseudo-grippaux et des troubles intestinaux chez 4 à 8%
des personnes infectées
Poliomyélite paralysante de type motrice et musculaire
Elle touche 0,1 à 2% des personnes essentiellement les
enfants avec 10% de mortalité
Les paralysies sont dues à la lyse des neurones moteurs

Virus
Sang
SNC
Anticorps
neutralisants
Gorge
0
Selles
5 10 15
Jours après le contage
Atteinte du SNCMalaise fébrile
Formes nerveuses
Formes fébriles pures
Formes asymptomatiques
toute la vie
durant parfois 3-4 mois
1-2%
90-95%
4-8%
Pour 100
personnes
infectées
Evolution d’une infection par le poliovirus
Protéines structurales Protéines non structurales
Polyprotéine (247 kDa)
Organisation structurale de l’ARN génomique du poliovirus
et expression des protéines virales
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%