Actemra (tocilizumab) – Formulaire d`Inscription

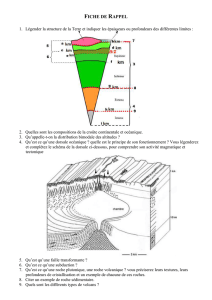
®
1. RENSEIGNEMENTS SUR LE PATIENT
2. Rx – VEUILLEZ ÉCRIRE LISIBLEMENT
COMMANDE D’ACTEMRA® (tocilizumab) pour le traitement de l’AJIs
Traitement initial Changement de dose* Renouvellement (veuillez joindre les renseignements sur la réponse du patient au tocilizumab, y compris les
résultats de laboratoire pertinents)
Pour le traitement de l’AJIs, la posologie recommandée est de 8 mg/kg toutes les 2 semaines pour les patients ≥ 30 kg, et de 12 mg/kg toutes les 2 semaines pour les patients < 30 kg.
ACTEMRA 8 mg/kg x kg = mg; Nbre de renouvellements
ACTEMRA 12 mg/kg x kg = mg; Nbre de renouvellements
* Ne changer la dose que si le poids du patient uctue constamment.
MÉDICAMENTS À PRENDRE, AU BESOIN, EN CAS DE RÉACTIONS À LA PERFUSION
Advenant une réaction à la perfusion, les médicaments ou traitements suivants peuvent être administrés au patient, sauf indication contraire (voir ci-dessous) :
Acétaminophène : 10-15 mg/kg (max. 60 mg/kg) par voie orale, au besoin, toutes les 4 à 6 heures, Oxygène : masque/pinces nasales, au besoin, en cas d’essouement ou de respiration siante
pour la douleur, la èvre et les frissons Salbutamol : 2 bouées d’aérosol toutes les 4 à 6 heures par aérochambre, au besoin, en cas de dyspnée ou de
Diménhydrinate : pour la nausée et les vomissements, selon le procotole en pédiatrie respiration siante
Diphéhydramine : pour les démangeaisons, le prurit et l’urticaire, selon le protocole en pédiatrie Autre :
Épinéphrine (1:1000) : 0,01 mL/kg (max. de 0,5 mL) par voie s.c./i.m., au besoin, toutes les
10 à 15 minutes x 2 en cas de réaction anaphylactique grave
Hydrocortisone : en cas de réaction allergique ou anaphylactique grave, selon le protocole en pédiatrie Médicaments à prendre au besoin non requis
PROGRAMME – TELÉC. : 1-888-532-1198
TÉL. : 1-888-748-8926
Nom : Prénom : Initiales : Sexe : M F
Date de naissance (jj/mm/aa) : N° d’assurance maladie :
Adresse du patient / représentant légal : Courriel :
Ville (Province) : Code postal :
Tél. (dom.) : Tél. (cell.) : Tél. (trav.) : Laisser un message : O N
Diagnostic / antécédents médicaux pertinents : Allergies :
Médicaments pris actuellement :
3. CONSENTEMENT DU PATIENT
05130F13
Signature du patient ou de son représentant légal : Date (jj/mm/aa) :
LES MODALITÉS DU CONSENTEMENT DU PATIENT FIGURENT AU VERSO. VEUILLEZ VOUS ASSURER DE LIRE ET DE BIEN COMPRENDRE CES MODALITÉS.
IMPORTANT : Si le consentement écrit du représentant légal du patient ne peut être obtenu, veuillez indiquer qu’un consentement verbal a été fourni pour
que l’on puisse poursuivre l’inscription au programme Jointeort (Eortconjoint). Le consentement écrit sera obtenu avant ou au moment de la première
perfusion.
Consentement verbal obtenu par le patient / représentant légal : Date (jj/mm/aa) :
© Copyright 2012-2013, Homann-La Roche Limitée
ACTEMRA® Marque déposée de Chugai Seiyaku Kabushiki Kaisha, utilisée sous licence
JointeortTM Marque de commerce de F. Homann-La Roche SA, utilisée sous licence
Nom du médecin (en majuscules) : Date (jj/mm/aa) :
Signature du médecin : Tél. du médecin : Téléc. :
Adresse du patient / représentant légal : Ville (Province) / Code postal :
Commentaires supplémentaires : Lieu de la clinique de perfusion : OU À déterminer par le programme
Jointeort™ (Eortconjoint)
veuillez préciser
Veuillez consulter la monographie pour obtenir des renseignements complets sur les
indications, les mises en garde, les précautions, les eets indésirables et le critères de
sélection des patients. Monographie fournie sur demande.
Veuillez consulter les renseignements posologiques pour obtenir des instructions
complètes sur le dosage et l’administration.
ACTEMRA® (tocilizumab) - FORMULAIRE D’INSCRIPTION
Arthrite juvénile idiopathique systémique (AJIs)

CONSENTEMENT DU PATIENT / REPRÉSENTANT LÉGAL
Au patient ou à son représentant légalement autorisé : veuillez lire attentivement cette section.
Je comprends qu’Innomar-Strategies Inc. (« Innomar ») a été engagé par Homann-La Roche Limitée (« Roche ») pour administrer le Programme
d’assistance aux patients Jointeort (« Eortconjoint »), conçu dans le but d’aider les patients résidant au Canada à avoir accès à un traitement
médical. Je conrme que les renseignements que j’ai fournis dans le présent formulaire d’inscription sont complets et exacts. Je comprends
que Roche se réserve le droit, en tout temps et sans préavis, de modier le présent formulaire d’inscription ou tout aspect du programme
Eortconjoint, y compris les critères d’admissibilité, ou de mettre n aux services et à l’assistance. Bien que Roche et Innomar s’eorcent d’aider
tous les demandeurs du programme Eortconjoint, ni l’une ni l’autre ne garantit l’accès au traitement.
Pour qu’Innomar puisse accomplir ses tâches dans le cadre du programme Eortconjoint, j’accepte qu’Innomar, ses employés et ses consultants
puissent obtenir des renseignements personnels me concernant, notamment mon nom, mon adresse, mon numéro de téléphone, des
renseignements nanciers, des renseignements sur ma santé (tels que mon état de santé et mon assurance maladie) directement de moi, de mon
représentant autorisé, de mon (mes) fournisseur(s) de soins de santé et/ou de mon (mes) assureur(s) de soins médicaux, le cas échéant, et qu’ils ne
les utilisent et ne les divulguent à titre condentiel que pour fournir et coordonner les services dans le cadre du programme Eortconjoint ou dans
les limites permises par la loi.
Les fournisseurs de soins de santé et les représentants du programme Eortconjoint ne sont pas autorisés à communiquer à Roche des
renseignements pouvant révéler mon identité, sauf à des ns limitées de vérication du rendement d’Innomar dans l’administration des services
du programme Eortconjoint. Cependant, j’accepte que certains aspects des renseignements concernant ma santé puissent être communiqués
à Roche par Innomar, dans un format qui ne dévoile aucun des renseignements personnels mentionnés ci-dessus. Je comprends également
que Roche est tenue de déclarer toute manifestation indésirable d’un médicament à Santé Canada et, par conséquent, j’autorise par la présente
Innomar à recueillir et à fournir au service de Pharmacovigilance de Roche les détails de toute manifestation indésirable qui pourrait se manifester
pendant que je prends les médicaments de Roche qui m’ont été prescrits. Ces détails ne dévoileront aucun des renseignements personnels
mentionnés ci-dessus, mais comprendront des identiants (initiales, date de naissance ou âge, taille, poids) et de l’information sur la manifestation
indésirable que je pourrais présenter. En cas de manifestation indésirable d’un médicament, je comprends qu’il est possible qu’Innomar ou le
service de Pharmacovigilance de Roche, ou les deux, me demandent l’autorisation de communiquer avec moi ou avec mon (mes) fournisseur(s)
de soins de santé si des précisions sur la manifestation sont nécessaires. Je comprends que tout renseignement sur une manifestation indésirable
d’un médicament, communiqué au service de Pharmacovigilance de Roche, sera conservé pendant la période prescrite par la loi et peut être
communiqué, à l’échelle internationale, au groupe Roche et aux organismes de réglementation, tel qu’exigé par les lois et règlements en vigueur.
Si, en tout temps et pour quelque raison que ce soit, Roche désigne une nouvelle entreprise pour remplacer Innomar à titre d’administrateur du
programme Eortconjoint, j’autorise par la présente le transfert, par Innomar, de mes dossiers personnels et médicaux au nouvel administrateur
désigné par Roche, pour que ma participation au programme Eortconjoint puisse se poursuivre de la même manière que celle stipulée ci-dessus.
Je comprends qu’après ce transfert, Innomar peut conserver ces dossiers ou leur copie an de se conformer aux lois et règlements relatifs à la
conservation des dossiers personnels et médicaux.
Je consens également à ce qu’un tiers fournisseur additionnel communique avec moi aux ns de sondages de suivi sur la satisfaction de la clientèle
à l’égard des services reçus dans le cadre du programme Eortconjoint, et à ce que mes coordonnées soient fournies à ce tiers à cette n.
Je sais que j’ai le droit de refuser de signer le consentement et de refuser la collecte, l’utilisation et la divulgation de mes renseignements
personnels, et qu’un tel refus pourrait limiter la capacité d’Innomar à fournir des services du programme Eortconjoint à mon nom.
Ce consentement est valide aussi longtemps que je reçois des services dans le cadre du programme Eortconjoint. Je comprends que je peux
retirer mon inscription et mon consentement en tout temps en envoyant ma demande par écrit à Innomar, par télécopieur, au 1-888-532-1198.
Mon retrait du programme sera immédiat dès réception de la lettre par Innomar, et toute collecte, utilisation ou communication de mes
renseignements personnels prendra n.
VEUILLEZ VOUS ASSURER DE LIRE ET DE BIEN COMPRENDRE LES MODALITÉS SUSMENTIONNÉES, PUIS DE SIGNER ET DATER LA SECTION
DU CONSENTEMENT DU PATIENT, AU VERSO.
1
/
2
100%