ii – biologie humaine

1
BACCALAUREAT STL – BGB
Epreuve de Biochimie - Biologie
I – BIOCHIMIE
Epuration biologique des eaux usées
I.1 Séparation des graisses
I.1.1 Plus faible densité des graisses par rapport aux autres matières organiques. Les graisses remontent
donc à la surface.
I.1.2
Acide palmitique : solide (rqe : car température de fusion > 25°C)
Acide stéarique : solide
Acide oléique : liquide (rqe : car température de fusion < 25°C)
Acide linoléique : liquide
Acide linolénique : liquide
Graisses les plus colmatantes = celles qui sont solides à 25°C = graisses contenant des acides palmitiques
et/ou stéariques.
I.2 Traitement des graisses
I.2.1 I.2.1.1
I.2.1.2
Lipase I.2.1.3
Les hydrolases
I.2.2 I.2.2.1
1 : HSCoA
2 : ATP
3 : FAD
4 : FADH2
5 : NAD+
6 : NADH,H+
7 : HSCoA
8 : Acétyl CoA
I.2.2.2
Voie B : – oxydation ou hélice de Lynen
I.2.2.3
hydroxystéaryl-CoA :
3 acides gras
Glycérol
Avec n = 14

2
I.2.2.4
Acétyl CoA :
I.2.2.5
Bilan moléculaire voie B :
Stéaryl-CoA + NAD+ + FAD + H2O + CoASH Palmityl CoA + NADH+ + H+ + FADH2 + Acétyl CoA
I.2.2.6
L’acide stéarique comporte 18 carbones.
Chaque tour d’hélice de Lynen détache 2 carbones sauf le dernier qui libère 2 fois 2 carbones Donc nombre de
tours = (nombres de carbones/2) – 1 = (18/2)-1 = 8
I.2.2.7
9 molécules d’acétyl CoA formées (18 /2).
I.2.3 I.2.3.1
Cycle de Krebs
I.2.3.2
Cette voie permet la dégradation de l’acétyl CoA, carrefour métabolique provenant de l’oxydation des matières
organiques présentes dans les eaux usées. Elle participe donc à l’épuration des eaux usées chargées en matières
organiques. I.2.3.3
Phosphorylation oxydative (chaîne respiratoire)
I.2.3.4
Membrane plasmique
I.3 Traitement des autres molécules organiques
I.3.1
Protéines : acides aminés liés par liaisons peptidiques
Polyosides : oses liés par liaisons osidiques
I.3.2
Glycogène
I.3.3 I.3.3.1
Décarboxylation oxydative
I.3.3.2
Complexe formé de l’assemblage de plusieurs sous-unités : enzyme et coenzymes.
I.3.3.3
Pyruvate déshydrogénase

3
II – BIOLOGIE HUMAINE
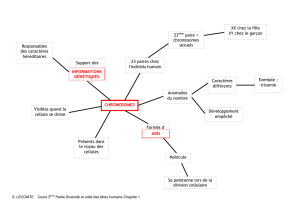
Etude d’une anomalie chromosomique : le syndrome de Turner
II.1 Diagnostic du syndrome de Turner
L’analyse du caryotype montre une anomalie au niveau des chromosomes sexuels (gonosomes) : on détecte la
présence d’un seul chromosome sexuel X, au lieu de la paire de chromosomes X (XX) présente normalement
chez une femme.
Le syndrome de Turner est donc due à une monosomie au niveau de la paire de chromosomes sexuels (formule
chromosomique : 45, X0).
II.2 Origine du syndrome de Turner
II.2.1
II.2.1.1
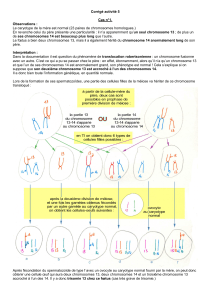
- Etape 1 : Prophase I – Prophase de la première division de méïose. La chromatine s’est condensée et les
chromosomes sont visibles (réunis par paires).
- Etape 2 : Métaphase I – Métaphase de la première division de méïose. Les chromosomes homologues
s’alignent par paires sur la plaque équatoriale.
- Etape 3 : Anaphase I – Anaphase de la première division de méïose. Les paires de chromosomes homologues
se séparent et chaque chromosome de chaque paire migre vers un pôle de la cellule.
- Etape 4 : Télophase I – La cellule initiale s’est divisée pour former 2 cellules identiques haploïdes (n
chromosomes à 2 chromatides).
- Etape 5 : Anaphase II – Anaphase de la deuxième division de méïose. Dans chacune des 2 cellules issues de la
méïose I, les chromatides de chaque chromosome migrent vers chaque pôle de la cellule.
- Etape 6 : Télophase II –Télophase de la deuxième division de méïose. Les 2 cellules se sont divisées pour
former 4 cellules haploïdes (n chromosomes à 1 chromatide).
II.2.1.2
Former des gamètes (cellules sexuelles) : cellules haploïdes comportant 23 chromosomes afin de maintenir,
après fusion des gamètes mâle et femelle un nombre diploïde de chromosomes dans la cellule œuf (46
chromosomes).
II.2.1.3
Ovocyte II.
Ce gamète n’a pas achevé le méïose : il est bloqué en métaphase II. La méïose ne sera achevée qu’en cas de
fécondation.
II.2.2
II.2.2.1
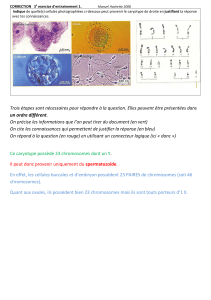
C’est la cellule A qui a fusionné avec un spermatozoïde pour donner naissance à la jeune malade. En effet on
remarque que cette cellule ne possède aucun chromosome sexuel.
Ceci est dû à une erreur au cours de la 1ère division de méïose : la paire de chromosomes sexuels ne s’est pas
séparée et les 2 chromosomes sexuels sont restés dans la cellule B.
II.2.2.2
La fusion de la cellule A avec le spermatozoïde donne ici naissance à une cellule œuf ne comportant qu’un seul
chromosome sexuel : c’est le chromosome (X) apporté par le spermatozoïde.
II.2.3 II.2.3.1
1 : Trompe de Fallope (ou trompe utérine)
2 : Follicule ovarien
3 : Ovaire
4 : Pavillon de la trompe

4
5 : Cavité utérine (utérus)
6 : Endomètre
7 : Myomètre
8 : Col de l’utérus
9 : Vagin II.2.3.2
Lieu de la fécondation : trompe de Fallope
Lieu de la nidation : endomètre (utérus).
II.3 Conséquences du syndrome de Turner
II.3.1 II .3.1.1
Substance synthétisée par une glande endocrine, libérée et transportée dans le sang en très petite quantité et
agissant sur un ou plusieurs organe(s) cible(s) en modifiant son (leur) activité(s).
II.3.1.2
Production de la LH par l’hypophyse.
Production de l’oestradiol par les ovaires.
II.3.1.3
Expérience 1 :
Ce résultat montre que lorsque la concentration en oestradiol est modérée, la concentration de LH reste faible.
L’oestradiol inhibe donc ici la production de LH.
Expérience 2 :
Ce résultat montre que lorsque la concentration en oestradiol est élevée, la concentration de LH augmente.
L’oestradiol stimule donc ici la production de LH.
L’oestradiol peut donc exercer un double effet sur la sécrétion de LH : un rétrocontrôle négatif à concentration
modérée ou un rétrocontrôle positif à forte concentration.
II.3.1.4
En cas de syndrome de Turner l’absence quasi-totale de production d’oestradiol, due à l’atrophie des ovaires
entraîne une sécrétion importante de LH (absence de rétrocontrôle négatif).
Le cycle menstruel étant notamment lié aux variations cycliques du taux d’oestradiol, en absence d’oestradiol il
n’y a pas de cycle menstruel (d’où la stérilité).
II.4 Traitement du syndrome de Turner
II.4.1
Hormone A : Oestradiol .Hormone produite lors de la 1ère moitié du cycle menstruel (phase 1), par le follicule
ovarien en développement.
Hormone B : Progestérone. Hormone produite lors de la 2ème moitié du cycle menstruel (phase 2) par le corps
jaune.
Phase 1 : phase folliculaire
Phase 2 : phase lutéale (ou lutéinique)
II.4.2
Dates d’ovulation : 20 septembre et 18 octobre
Dates des menstruations : à partir du 6 septembre et à partir du 4 octobre.

5
III. MICROBIOLOGIE
Les bactériophages
III.1 Structure des bactériophages
III.1.1
Virus : particule infectieuse se multipliant en parasitant une cellule hôte.
III.1.2
1 : Tête
2 : Queue
3 : Capside
4 : Acide nucléique (ADN)
5 : Gaine caudale (contractile)
6 : Canal caudal
7 : fibres (filaments) caudales
8 : épines caudales (spicules)
III.2 Multiplication des bactériophages
III.2.1
Structures phagiques : fibres caudales
Structure bactérienne : paroi
III.2.2
Les fibres caudales du bactériophage T4 reconnaissent de manière spécifique des récepteurs de la paroi
bactérienne (situés au niveau du LPS de la membrane externe) d’E.coli.
III.2.3
Etape A : synthèse de l’ARN messager = transcription de l’ADN viral
Etape B : synthèse protéique = traduction de l’ARN messager viral
Etape C : synthèse d’ADN = réplication de l’ADN
Molécule 1 : ARN messager viral
Molécule 2 : ADN viral
III.2.4
Bactériophage dit virulent car il lyse (détruit) toutes les bactéries qu’il infecte.
III.2.5
La lysogénie : l’ADN du bactériophage s’intègre, après injection , au chromosome bactérien et se réplique en
même temps que lui. Sous cette forme, le bactériophage est appelé prophage.
Ce type de phage est qualifié de tempéré.
III.3 Utilisation des bactériophages en thérapie
III.3.1
Antibiotique : substance antibactérienne, détruisant les bactéries (bactéricide) ou inhibant leur croissance
(bactériostatique).
III.3.2
Production par la bactérie d’enzymes détruisant les antibiotiques (ex : pénicillinase)
III.3.3
Acquisition de plasmides porteurs de gènes de résistance aux antibiotiques.
III.3.4
Bactériophages virulents puisqu’ils ont la capacité de détruire les bactéries.
 6
6
1
/
6
100%