GUIDE — Rétroaction des patients au Programme

GUIDE — Rétroaction des patients au
Programme commun d’évaluation des
médicaments de l’ACMTS
Guide sur la rétroaction des patients au PCEM de l’ACMTS page 1 sur 7
Janvier 2014
Table des matières
1. Introduction
2. Contexte
3. Procédure d’évaluation
4. Rétroaction des patients
5. Mécanisme de rétroaction
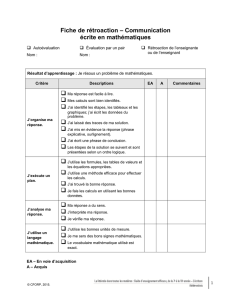
6. Fiche de rétroaction
7. Confidentialité
8. Votre avis
1. Introduction
L’Agence canadienne des médicaments et des technologies de la santé (ACMTS) a élaboré
une approche formelle à la prise en compte de l’opinion des patients à la procédure d’évaluation
du Programme commun d’évaluation des médicaments (PCEM). Le PCEM formule des
recommandations quant à la liste des médicaments assurés destinées aux régimes
d’assurance-médicaments publics. Le présent guide s’adresse aux groupes de patients
désireux de transmettre leur opinion concernant les médicaments en cours d’examen par le
PCEM.
2. Contexte
Rôle du Programme commun d’évaluation des médicaments
Les gouvernements fédéral, provinciaux et territoriaux ont mis sur pied le PCEM afin d’offrir aux
régimes d’assurance-médicaments publics (sauf celui du Québec) les mêmes examens
cliniques et économiques rigoureux de médicaments et les mêmes avis d’experts dans le but
d’éclairer leur prise de décisions.
Le PCEM effectue des examens objectifs et rigoureux de l’innocuité et de l’efficacité des
médicaments et de leur rentabilité (rapport qualité-prix) par rapport à d’autres traitements
disponibles. Le Comité canadien d’expertise sur les médicaments (CCEM), un organe
consultatif de l’ACMTS composé d’experts dans les domaines de la pharmacothérapie et de
l’évaluation de médicaments et de représentants du public, se fonde sur ces examens pour
formuler ses recommandations aux régimes d’assurance-médicaments.
Médicaments évalués par le Programme commun d’évaluation des médicaments
En général, le PCEM examine de nouveaux médicaments ou des médicaments connus dans
une nouvelle indication.
En fait, le PCEM évalue la couverture des médicaments dont Santé Canada a autorisé la
commercialisation au Canada. Lorsque le ministère autorise la mise sur le marché du
médicament, elle délivre un avis de conformité (AC) ou un avis de conformité avec conditions
(AC-C) au fabricant.

Agence canadienne des médicaments et des technologies de la santé (ACMTS)
Guide sur la rétroaction des patients au PCEM de l’ACMTS page 2 sur 7
Janvier 2014
Le PCEM peut examiner un médicament avant que Santé Canada en ait autorisé la
commercialisation lorsque le fabricant le soumet aux fins d’examen prioritaire avant la
délivrance de l’AC et qu’il satisfait les critères de cet examen prioritaire. L’examen avant la
délivrance de l’AC a pour objectif de rendre le médicament plus rapidement accessible aux
régimes d’assurance-médicaments sans compromettre la qualité de l’évaluation par le PCEM.
À propos du rôle de Santé Canada
Santé Canada autorise la vente de médicaments au Canada après avoir examiné l’information
scientifique sur leur innocuité, efficacité et qualité, comme le prévoit la réglementation. Santé
Canada ne prend pas en considération le coût des médicaments. Si Santé Canada détermine
que les avantages potentiels du produit l’emportent sur les risques que comporte son utilisation
et que le produit se conforme aux normes de qualité, il en approuve la mise sur le marché.
Régimes d’assurance-médicaments publics
Des régimes d’assurance-médicaments publics ont été établis dans chaque province et
territoire du Canada et pour certains ministères fédéraux. Tous ces régimes publics, à
l’exception de celui du Québec, participent au PCEM. Les régimes prennent leurs propres
décisions quant aux médicaments qu’ils assurent. Dans cette prise de décisions, ils tiennent
compte non seulement des examens de couverture du PCEM et des recommandations du
CCEM, mais également de leur propre mandat ainsi que des priorités et des ressources
financières de la province ou du territoire.
3. Procédure d’évaluation du PCEM
Amorçage : La procédure d’évaluation s’amorce lorsque l’ACMTS reçoit une demande
d’examen du fabricant du médicament ou des régimes d’assurance-médicaments participants.
Elle en reçoit environ 35 chaque année.
Examen du PCEM : L’ACMTS examine les données probantes d’ordre clinique, scientifique et
économique sur le médicament par comparaison avec les autres traitements offerts dans la
mesure du possible. Les données probantes examinées par le PCEM sont issues de sa
recherche systématique de la documentation scientifique, de l’information fournie par le
fabricant, de la rétroaction de spécialistes, et maintenant, de groupes de patients. L’ACMTS
rend compte de cet examen dans des rapports, l’un clinique, l’autre économique, rigoureux et
exhaustifs.
Recommandation du CCEM : Le CCEM fonde sa recommandation sur l’étude de ces rapports
exhaustifs. Pour chaque médicament, il prend en considération l’efficacité clinique, l’innocuité,
la rentabilité (rapport qualité-prix) du médicament, ainsi que les points de vue du public et des
patients sur le médicament, comparativement aux autres traitements offerts. La
recommandation finale paraît dans la base de données sur les médicaments du PCEM sur le
site Web de l’ACMTS, auquel le public a accès.
Industrie pharmaceutique : Le fabricant du médicament à l’étude a l’occasion d’exprimer ses
observations sur les rapports d’évaluation et sur la recommandation du CCEM et de demander
que la celle-ci soit réexaminée.

Agence canadienne des médicaments et des technologies de la santé (ACMTS)
Guide sur la rétroaction des patients au PCEM de l’ACMTS page 3 sur 7
Janvier 2014
Calendrier d’exécution : L’ACMTS franchit les étapes de la procédure d’évaluation dans les délais
serrés déterminés. L’évaluation dans son ensemble, de la réception de la demande d’examen par
l’ACMTS à la parution de la recommandation du CCEM, se déroule en cinq à six mois. Les étapes
du processus du PCEM et le calendrier d'exécution de l’évaluation du médicament figurent à la
rubrique du PCEM sur le site Web de l’ACMTS, tandis que tous les renseignements paraissent
dans la Procedure for Common Drug Review. La figure 1 illustre le processus.
Figure 1 : Procédure d’évaluation du PCEM

Agence canadienne des médicaments et des technologies de la santé (ACMTS)
Guide sur la rétroaction des patients au PCEM de l’ACMTS page 4 sur 7
Janvier 2014
4. Rétroaction des patients
Importance de la rétroaction des patients
L’ACMTS et le CCEM évaluent les médicaments en se penchant sur l’information contenue
dans la demande d’examen du fabricant, sur la documentation scientifique et les données
issues de la recherche, recensées dans le cadre de la recherche documentaire, ainsi que sur
l’opinion de spécialistes ou d’experts. Aucun mécanisme ne prévoyait avant aujourd’hui la prise
en compte systématique du point de vue des patients sur le médicament ou sur la maladie en
question dans le processus d’évaluation du PCEM. Grâce au mécanisme de rétroaction des
patients, cette information importante sera prise en considération en bonne et due forme.
Prise en compte de la rétroaction des patients
La rétroaction des patients est transmise, sous sa forme originale et sous la forme d’une
compilation :
aux examinateurs de l’ACMTS qui incorporeront les aspects de l’état de santé ou du
médicament mentionnés par les patients dans la planification de l’évaluation du médicament
et dans les rapports d’examen clinique et économique du PCEM;
au CCEM qui s’en inspirera au même titre que les examens clinique et économique du
PCEM afin de formuler la recommandation à propos du médicament. Les représentants du
public membres du CCEM examineront la rétroaction des patients avant d’en faire état au
moment des délibérations du CCEM.
La rétroaction des patients et les régimes d’assurance-médicaments
Les régimes d’assurance-médicaments participants sont conscients eux aussi de l’importance
de l’opinion des patients, et certains en tiennent compte déjà dans leur processus décisionnel.
C’est dans ce contexte que l’ACMTS et le comité consultatif d’experts ont établi le mécanisme
décrit ici de concert avec les régimes d’assurance-médicaments. Il est prévu que les
mécanismes de l’ACMTS et des régimes d’assurance-médicaments soient complémentaires,
qu’ils facilitent la collecte d’information provenant des patients qui correspond aux besoins de
tous.
Transmission de la rétroaction des patients aux régimes d’assurance-
médicaments
La rétroaction des patients reçue par l’ACMTS est communiquée aux régimes d’assurance-
médicaments comme suit :
La rétroaction des patients est prise en compte dans les rapports d’examen de couverture
du PCEM qui sont transmis aux régimes d’assurance-médicaments participants.
Toutes les observations de groupes de patients sont transmises dans leur intégralité aux
régimes d’assurance-médicaments et au CCEM.
Les recommandations du CCEM dont s’inspirent les régimes d’assurance-médicaments
dans leur prise de décisions prennent en considération la rétroaction des patients.

Agence canadienne des médicaments et des technologies de la santé (ACMTS)
Guide sur la rétroaction des patients au PCEM de l’ACMTS page 5 sur 7
Janvier 2014
5. Mécanisme de rétroaction
Qui peut exprimer son opinion?
Tout groupe de patients désireux de s’exprimer sur un médicament à l’étude par le PCEM peut
transmettre ses observations par écrit à l’ACMTS à l’aide de la fiche de rétroaction Template for
Submitting Patient Group Input to the Common Drug Review at CADTH (en anglais).
L’ACMTS n’acceptera pas les observations d’un patient ou d’un proche aidant seul. Ceux-ci
sont priés de se joindre à un groupe de patients pour s’exprimer sur le sujet à l’étude ou de
demander à ce groupe d’inclure leurs observations dans son exposé.
Quand soumettre la rétroaction des patients à l’ACMTS?
Site Web de l’ACMTS : L’ACMTS présente sur la page de rétroaction des patients de son
site Web le titre de la demande d’examen à venir ou reçue, le nom du fabricant, l’indication
approuvée du médicament et la date limite de la transmission de la rétroaction des patients.
Abonnement à l’avis électronique de présentation d’une demande d’examen :
L’ACMTS envoie un courriel aux abonnés du service « demande de rétroaction de
patients » pour les informer des demandes prévues et des demandes reçues. Le courriel
d’avis est envoyé quelques heures après la réception de la demande d’examen ou de l’avis
de demande à venir. Les groupes de patients et les personnes souhaitant s’abonner à ce
courriel sont priés de consulter la page abonnez-vous du site Web de l’ACMTS.
Calendrier de rétroaction
L’ACMTS accorde aux groupes de patients une période de rétroaction de 15 jours ouvrables
(trois semaines) à compter de la réception de la demande d’examen du fabricant ou d’un
régime d’assurance-médicaments. Dans le cas d’un préavis de demande d’examen à venir, la
période de rétroaction est prolongée d’autant de jours ouvrables que le nombre de jours du
préavis (10 jours au maximum) de sorte qu’elle peut s’étirer sur 25 jours ouvrables en tout et
pour tout. (Note : le préavis de demande d’examen à venir n’est pas obligatoire.)
Ce calendrier a été établi de sorte que la rétroaction puisse influencer vraiment le processus
d’examen du PCEM. Ainsi, les examinateurs de l’ACMTS seront en mesure de tenir compte des
sujets et des résultats eu égard au médicament qui revêtent de l’importance pour les patients
dans l’élaboration du protocole d’évaluation du médicament. L’élaboration du protocole
représente une étape cruciale à l’amont du processus qui permet d’établir un projet ou une série
de démarches afin de réaliser l’évaluation du médicament.
Démarche de rétroaction
1. Prenez connaissance du présent guide qui précise l’information que recherche l’ACMTS, la
façon dont elle est intégrée à la procédure du PCEM et le mode de transmission de la
rétroaction.
2. Téléchargez la fiche de rétroaction intitulée Template for Submitting Patient Input to the
Common Drug Review at CADTH, disponible uniquement en anglais, qui paraît à la page de
rétroaction des patients sur le site Web de l’ACMTS. Elle présente des exemples précis
d’information utile aux examinateurs de l’ACMTS et au CCEM.
 6
6
 7
7
1
/
7
100%