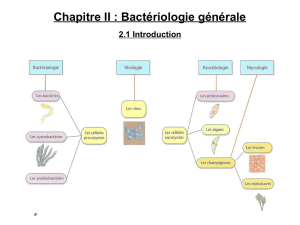
Comment rompre une capsule postérieure

À SAVOIR
Pratiques en Ophtalmologie • mars 2016 • vol. 10 • numéro 86 11
*Centre laser Victor Hugo, Paris
La capsule postérieure participe
avec la zonule cristallinienne à
la barrière vitréo-aqueuse main-
tenue lors de l’extraction extra-
capsulaire du cristallin, réalisée
maintenant toujours par phaco-
émulsification.
Une rupture capsulaire posté-
rieure en cours d’intervention avec
les risques de chute du noyau est
toujours une complication grave
grevant le pronostic. Ce titre très
provocateur permet d’attirer l’at-
tention sur le fait que la question
du caractère aléatoire d’une rup-
ture capsulaire peut se discuter.
En effet les mécanismes, ainsi
que les causes possibles, d’une
rupture capsulaire postérieure
en cours de phacoémulsification
méritent que l’on étudie en détail
leur possibilité de survenue, sans
que nous étudiions ici la gestion
des complications. Peut-être
que seul le “mot de Cambronne”
devrait suivre la constatation im-
médiate – ou non – d’une rupture
capsulaire ! Les milliers d’études
montrant la supériorité de l’ex-
traction extracapsulaire (EEC) sur
l’extraction intracapsulaire (EIC)
concernent en fait les deux bar-
rières que sont la capsule posté-
rieure et le rideau zonulaire com-
plet rompu par EIC (1).
zonulaires reliant l’équateur cris-
tallinien aux procès ciliaires, avec
des fibres dont l’élongation peut
être physiologiquement de 100%
(Fig. 2)
.
Ce rideau zonulaire relie le corps
ciliaire à l’équateur du cristallin
FIGURE 1 Ligament de Wieger (1) et espace de Berger (2).
FIGURE 2 Fibres cilio-équatoriales de la zonule, photographie extraite de (1).
Comment rompre une
capsule postérieure ?
Phacoémulsification: roulette russe ou déterminisme ?
Dr Alain Hagège*
Anatomiquement, rappelons
que la capsule postérieure est
séparée de la hyaloïde antérieure
du vitré par le ligament circulaire
de Wieger délimitant l’espace de
Berger
(Fig. 1)
. La zonule consti-
tue un maillage très serré et très
hermétique constitué des fibres

À SAVOIR
2 Pratiques en Ophtalmologie • mars 2016 • vol. 10 • numéro 863
FIGURE 3 Distance entre l’équateur
cristallinien et la tête des procès
ciliaires.
FIGURE 5 Dépôts de matériel exfolia-
tif sur la capsule antérieure.
FIGURE 6 Hydrodissection.
FIGURE 4 Zone de capsule antérieure
libre de fibres zonulaires.
qui est situé à environ 0,2-0,3mm
des procès ciliaires
(Fig. 3)
. Les
fibres zonulaires qui partent des
extrémités des procès ciliaires
atteignent l’équateur cristallinien
et la couronne de capsule posté-
rieure sur quelques millimètres
en arrière, ainsi que l’extrémité de
la capsule antérieure en avant.
Cela laisse un diamètre de cap-
sule antérieure de 6,5mm libre de
fibrilles zonulaires
(Fig. 4)
. Cela ex-
plique pourquoi les capsulorhexis
dits “trop grands” ont tendance à
filer dès que la découpe est gui-
dée vers l’extérieur par le “rail” de
fibres zonulaires périphériques,
surtout en présence de fibres
zonulaires ectopiques se rappro-
chant du centre capsulaire.
En définitive, la rupture des com-
posants du sac capsulaire peut
concerner la capsule antérieure,
la capsule postérieure ou les deux,
mais on peut aussi y inclure une
rupture de l’appareil zonulaire.
RUPTURES ZONULAIRES
Les ruptures zonulaires peuvent
concerner tout ou partie du
disque zonulaire. Une rup-
ture zonulaire pouvant aller de
quelques degrés (parfois diffici-
lement décelable en préopéra-
toire) à plusieurs dizaines de de-
grés, prenant alors l’appellation
de désinsertion zonulaire. Une
désinsertion zonulaire peropéra-
toire sur 360° correspondra alors
à une extraction intracapsulaire
avec ou sans issue de vitré (non
systématique si la hyaloïde n’est
pas rompue). Ces ruptures, à la
différence des ruptures capsu-
laires, peuvent être préexistantes
et, dans ce cas, le plus souvent
traumatiques (subluxation cris-
tallinienne, traumatisme zonu-
laire localisé). En l’absence de
traumatisme, les facteurs fragili-
sant la zonule sont multiples, par
exemple l’âge élevé, le diabète,
la myopie forte, les yeux vitrecto-
misés avec présence de silicone
intravitréen ou encore la pseudo-
exfoliation capsulaire
(Fig.5)
.
Le syndrome exfoliatif est clas-
siquement toujours cité comme
risque majeur de rupture zonu-
laire en raison de la fragilité des
fibres zonulaires et des dépôts de
matériel exfoliatif sur les fibrilles,
mais aussi sur la capsule anté-
rieure (typiquement “en cocarde”).
La pseudo-exfoliation capsulaire
(PEC), qui était typiquement une
contre-indication formelle à la
phacoémulsification à ses débuts,
en est devenue une indication sur
le tard ! En effet, les tractions zo-
nulaires exercées par la chirurgie
des pionniers de la phacoémulsi-
fication ont été responsables de
beaucoup de ruptures zonulaires
avec issues de vitré peropéra-
toires, voire de chute du cristallin
dans la cavité vitréenne, jusqu’à ce
que l’on se rende compte qu’une
chirurgie intrasacculaire de type
cracking rendait les tractions zo-
nulaires moins prononcées, trans-
formant finalement de nos jours la
PEC en indication de phacoémul-
sification. L’extraction de la cata-
racte dans ces cas semble réduire
les risques de glaucome.
Faudra-t-il donc, en peropératoire,
invoquer la fragilité des struc-
tures oculaires concernées pour
expliquer ce qui est peut-être iatro-
gène ? En effet, les manipulations
de rotation du noyau cristallinien
peuvent parfois être responsables
de ruptures zonulaires localisées
lorsque l’hydrodissection
(Fig. 6)
n’est pas complète. De plus, il est

Comment rompre une capsule postérieure ?
Pratiques en Ophtalmologie • mars 2016 • vol. 10 • numéro 86 31
difficile de croire qu’une capsule
postérieure puisse “exploser”
par la trop grande pression d’une
hydrodissection, quand une ouver-
ture antérieure (nommée capsu-
lorhexis) peut laisser échapper le
trop-plein par le haut ! Un trait de
refend méconnu pourrait simple-
ment expliquer la “continuation”
de ce refend capsulaire antérieur
vers la capsule postérieure, à la
faveur du déséquilibre du sac créé
par la pression d’eau d’une hydro-
dissection. Il suffit de comparer la
pression de cette injection (à la se-
ringue) avec la pression d’eau exer-
cée par la hauteur de la bouteille de
perfusion durant la phacoémulsifi-
cation, et qui n’entraîne jamais de
rupture capsulaire postérieure (en
l’absence de trait de refend).
Après hydrodissection, le fait
de “faire tourner le noyau” per-
met de décoller au maximum le
noyau et le cortex de la capsule
postérieure, mais une rotation
exagérée peut entraîner la rota-
tion du sac lui-même et générer
des ruptures zonulaires, même
dans les cas où la zonule est en
bon état. Une douleur à la rota-
tion (si l’anesthésie est topique)
peut renseigner sur la traction
ciliaire. En effet, en anesthésie
topique, les structures irienne
et ciliaire restent sensibles et
permettent de renseigner sur la
qualité des manœuvres endocu-
laires. L’hydrodélinéation permet
de séparer le noyau du cortex, et
il faudra toujours veiller à ne pas
prendre une hydrodélinéation su-
perficielle pour une hydrodissec-
tion. En cas de cataracte blanche,
l’utilisation du bleu trypan facilite
la réalisation du capsulorhexis,
et une hydrodissection “au bleu”
pourra permettre de ne pas creu-
ser trop profondément lors de la
sculpture des sillons. En mode
phacoémulsification, il est rare
qu’une rupture zonulaire engen-
drée par la sonde ultrasonore (US)
n’entraîne pas une rupture cap-
sulaire équatoriale associée avec
issue de vitré. En mode irrigation/
aspiration (I/A), en fin de lavage
du cortex, il arrive souvent d’ob-
server des débris sous la capsule
postérieure
(Fig. 7)
. Ces débris cor-
respondent en fait au passage, par
une microrupture de la zonule (de
quelques degrés), de BSS et/ou de
particules de taille plus ou moins
importante en arrière de la cap-
sule postérieure, mais en avant de
la hyaloïde antérieure du vitré par
rupture du ligament de Wieger et
ouverture de l’espace virtuel de
Berger. Ce passage de fluide et/ou
de particules (cortex ou morceaux
de noyau cristallinien) en arrière
de la capsule postérieure entraîne
souvent un collapsus du sac cap-
sulaire que l’augmentation de la
pression de perfusion n’arrange
pas
(Fig. 8)
. Cette hyperpression est
souvent prise pour une poussée
du vitré, mais là aussi comment
penser que le vitré puisse “pous-
ser” ?! Seule une pression externe
pourrait provoquer ce qui est sou-
vent confondu avec une poussée
vitréenne. En cas de “syndrome
du hiatus zonulaire”, le réflexe en
présence de collapsus du sac est
d’augmenter la hauteur de la bou-
teille de perfusion, mais ceci n’est
pas recommandé dans ce cas, où
la profondeur de chambre anté-
rieure est maintenue: c’est inver-
sement la diminution de la hau-
teur de la bouteille de perfusion
qui peut permettre d’arranger les
choses.
Il faut savoir reconnaître ce syn-
drome afin de ne pas perforer sans
le savoir la capsule postérieure à
la recherche de fragments. Seul le
produit viscoélastique permet de
remplir le sac capsulaire, pouvant
parfois faire repasser les particules
en sens inverse. Un mouvement la-
téral de ces fragments permet de
FIGURE 7 Phaco bimanuelle – particules en arrière de la capsule posté-
rieure intacte.
FIGURE 8 Passage de particules par un “hiatus zonulaire” sans et avec
trait de refend capsulaire.

À SAVOIR
4 Pratiques en Ophtalmologie • mars 2016 • vol. 10 • numéro 863
les différencier de corps flottants
vitréens (mouvement vers le bas).
Les causes de ces microruptures
zonulaires sont multiples, car, en
dehors de la fragilité intrinsèque
de la zonule, des tractions exer-
cées sur la zonule par la canule
d’I/A lors de l’extraction du cortex
ou lors du polissage de la capsule
antérieure peuvent être respon-
sables de tractions zonulaires avec
ruptures localisées au-delà de la
faculté d’élongation intrinsèque
de cette structure
(Fig. 9)
(2). Enfin,
on peut rapprocher de ceci la dis-
cussion sur l’existence réelle des
masses adhérentes, et il nous
semble qu’il s’agisse plutôt d’une
traction capsulaire simultanée ou
d’une mauvaise hydrodissection.
L’injection dans le sac capsulaire,
avant la réalisation de la phacoé-
mulsification du noyau et après
la réalisation du capsulorhexis et
de l’hydrodissection, d’un anneau
de contention zonulaire est pos-
sible et peut permettre à l’inter-
vention de se dérouler normale-
ment en cas de rupture zonulaire
bien visible. De même, l’injection
de cet anneau de tension capsu-
laire dit de “Morscher” dans un
sac vide avant l’implantation peut
permettre de pérenniser le cen-
trage de l’implant. Enfin, on peut
se questionner sur l’utilité du
polissage capsulaire postérieur
(hormis celui du cortex) quand
on sait qu’il n’y a pas de cellules
sur la capsule postérieure (3, 4)
(Fig. 10)
et que l’opacification cap-
sulaire postérieure correspond à
une migration cellulaire (perles
d’Elschnig) et une métaplasie cel-
lulaire (fibrose capsulaire) (5).
Citons aussi le fait qu’en postopé-
ratoire la structure des zonules et
des capsules se modifie et change
de résistance ; par exemple, lors
d’une reposition d’implant, on
peut constater une élongation plus
grande des fibres zonulaires et une
résistance accrue des capsules qui
peuvent parfois rendre difficile un
changement d’implant
(Fig. 11)
.
RUPTURES CAPSULAIRES
La rupture capsulaire postérieure
est une complication grave de
la phacoémulsification faisant
perdre au patient les avantages
de l’EEC. En effet, la barrière zo-
nulaire très serrée participe avec
la capsule postérieure à la sépa-
ration entre les chambres anté-
rieure et postérieure et la cavité
vitréenne. La fragilité capsulaire
est souvent accusée, dans cer-
tains cas de rupture, d’être res-
ponsable de ruptures spontanées,
mais on peut se demander com-
ment il est possible d’accuser une
capsule postérieure d’être trop
fragile, au vu des instruments
utilisés dans l’œil pendant une
intervention ! Il est vrai que la visi-
bilité n’est pas toujours bonne et
qu’une mauvaise dilatation pupil-
laire peut rendre le travail sous
l’iris très dangereux. Les ruptures
peuvent concerner la capsule an-
térieure, la capsule postérieure
ou les deux.
RUPTURE CAPSULAIRE
ANTÉRIEURE
Il s’agit le plus souvent de traits de
refend capsulaires antérieurs qui
peuvent survenir soit pendant la
FIGURE 9 Lavage capsulaire antérieur et équatorial (vue de Miyake) et traction zonulaire.
FIGURE 10 Cellules épithéliales
antérieures et équatoriales.
FIGURE 11 Faculté d’élongation
de la zonule en postopératoire lors
d’une reposition d’implant.

Comment rompre une capsule postérieure ?
Pratiques en Ophtalmologie • mars 2016 • vol. 10 • numéro 86 51
réalisation du capsulorhexis lui-
même
(Fig. 12)
, soit encore après
la réalisation d’un capsulorhexis
intact, mais rompu involontai-
rement par la sonde US, le plus
souvent lors de la réalisation des
sillons. Exceptionnellement, une
blessure involontaire de la cap-
sule antérieure par le couteau
lors de l’incision peut perturber le
déroulement complet d’un capsu-
lorhexis sans trait de refend.
En cas de traits de refend mul-
tiples, le sac capsulaire prend
le nom de “false bag” des Anglo-
saxons et entraîne une instabi-
lité maximum de ce sac lors des
manœuvres d’extraction du noyau
ou du cortex
(Fig. 13)
(4, 6). En effet,
l’intérêt du capsulorhexis réside
dans la possibilité de dilatation
relative et de résistance aux ma-
nœuvres de phacoémulsification
du noyau et de lavage cortical.
Les lasers de femto-cataracte
ont permis la réalisation de cap-
sulorhexis de bon centrage, de
forme circulaire et de taille adé-
quate. La réussite semble plus
constante que les capsulorhexis
“faits main”, mais il a été décrit
des traitements incomplets, com-
plets mais avec discontinuité, ou
encore des microadhésions entre
les micropunctures
(Fig. 14)
. Ces
problèmes (à reconnaître avant
l’extraction de la capsulotomie
circulaire) peuvent être dus à la
présence de plis cornéens non
compensés durant la femto-cap-
sulotomie, de tilt cristallinien ou
de mouvements oculaires incon-
trôlés pendant le FLACS (Fem-
tosecond Laser-Assisted Cataract
Surgery) (7). Cependant, d’autres
études notent une résistance ac-
crue du capsulorhexis après dé-
coupe par laser femtoseconde (8).
Les ouvertures capsulaires type
“can opener” ou capsulotomie dite
“en timbre-poste” des interven-
tions extracapsulaires manuelles
(Fig. 15)
avant l’arrivée de la pha-
coémulsification sont une repré-
sentation typique d’un sac capsu-
laire à traits de refend multiples.
Les débuts de la phacoémulsifica-
tion ont vu ce type d’ouverture être
utilisé, malheureusement avec les
mauvais résultats qui s’ensuivirent
avant l’arrivée du capsulorhexis
par Gimbel et Neuhan en 1985. Les
mauvais résultats étaient dus à la
continuation, vers la capsule pos-
térieure, d’un trait de refend anté-
rieur plus grand que les autres
en mode US ou en I/A. En réalité,
traits de refend capsulaires anté-
rieurs et postérieurs sont liés.
C’est ce qui se passe aujourd’hui
FIGURE 12 Trait de refend capsulaire dont les berges sont maintenues par
les fibres zonulaires.
FIGURE 13 Multiples traits de refend capsulaires.
FIGURE 14 Différentes possibilités de femto-rhexis.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%