tableau avancement structure et géométries des molécules et la

DEVOIR'
1S'
THÈME':'OBSERVER/AVANCEMENT'D’UNE'RÉACTION'CHIMIQUE/GÉOMÉTRIE'DES'MOLÉCULES'
COMPRENDRE/'LA'LIASION'CHIMIQUE'
'
NOM':' '............................'' PRÉNOM':'.......................'' CLASSE':'...................'' DATE':''......................................''
Exercice 1 : Avancement d’une réaction chimique
Un artificier prépare un feu de Bengale rouge.
Il mélange 51,3 g de chlorate de potassium KClO3(s), 8,0 g de soufre S (s) et 9,0 g de carbone C (s).
Lors de la mise à feu, il se produit la réaction d’équation : ci-dessous
Données :
- Masses molaires atomique
M(S) = 32,1 g.mol-1; M(C) = 12,0 g.mol-1 ;M(Cl) = 35,5 g.mol-1 ; M(K) = 39,1 g.mol-1 ;M(O) = 16,0 g.mol-1
- Volume Molaire des gaz dans les conditions de température et de pression ordinaires : Vm = 24,0 L.mol-1
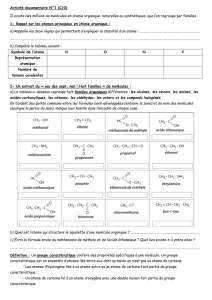
1. Calculer*les*quantités*de*matière*des*réactifs*à*l’état*initial.*
2. Compléter*le*tableau*d’avancement*sous*forme*littérale**
3. Quel*est**le*réactif*limitant*?*
4. Déterminer*la*valeur*de*l’avancement*maximal**
5. En*déduire*la*masse*de*sulfure*de*potassium*K2S(s)*à*l’état*final.**
6. Déterminer*le*volume*de*dioxyde*de*carbone*produit*(dans*les*conditions*de*température*et*de*pression*
ordinaire*
Équation de la réaction
2 KClO3(s) + S(s) + 3 C(s)
!
K2S(s) + 3 CO2(g) + Cl2(g)
État
Avancement
(mol)
Quantités de matière (en mol)
Initial
x =
Intermédiaire
x
Final
xmax =
Exercice'2':'structure'des'molécules':'formule'de'Lewis'''
Les$débuts$de$la$synthèse$organique$
Au*début*du*XIXème*siècle,*le*chimiste*allemand*Friedrich*Wöhler*réalise*la*première*synthèse*artificielle*
d’une*molécule*produite*par*les*organismes*vivants*:*l’urée.*
L’urée*est*obtenu*par*l’action*de*l’acide*cyanique**sur*l’ammoniac*A*selon*la*réaction**d’équation**
HOCN*+*A*
!
*H2N—CO—NH2*
1. Déduire*de*l’équation*chimique*la*formule*brute**de*la*molécule*A*
2. Rappeler*le*nombre*de*liaisons*qu’établissent*les*atomes*d’hydrogène*;*de*carbone*;*d’azote*et*d’oxygène*
3. Proposer*une*formule*de*Lewis*de*la*molécule*A*
On*donne*sur*les*figures*ci_dessous*les*enchaînements*des*atomes*des*atomes*dans*les*molécules*d’acide*
Cyanique*(a)*et*d’urée*(b)*
*
*
*
*
*
*
4. Construire*les*formules*de*Lewis*de*ces*deux*molécules**
5. En*déduire,*en*justifiant,**
a)*les*géométries*des$doublets$liants$et$non$liants*entourant*l’atome*de*carbone,*l’atome*d’azote*et*
l’atome*d’oxygène*de*la*molécule*d’acide*cyanique*
b)**les*géométries*des$liaisons*qu’établissent*l’atome*de*carbone*l’atome*d’azote*et*les*atomes*d’oxygène*
dans*cette*même**molécule*d’urée*
*
*
a)*acide*cyanique*
b)*urée*

Exercice'3':'structure'des'molécules':'stéréoisomérie'''
Les*terpènes,*sont*des*molécules*naturelles*formées*de*plusieurs*"briques"*élémentaire*de*même*squelette*
(chaîne*carbonée)*que*l'isoprène,*la**formule*semi_développée*de*l’isoprène*est*représentée*ci_dessous*
De*la*fleur*de*Bigaradier*on*extrait*l’essence*de*Néroli.*Cette*huile*essentielle*contient**du*nérol,*du*
géraniol*et*du*linalol.*
Le*nérol,*de*formule*semi_développée*ci_dessous,**fait*partie*de*la*famille*des*terpènes*utilisés*en*
parfumerie*pour*son*agréable*parfum*de*rose.'
Isoprène*
*
*
nérol'
*
Linalol*
'
1. La*molécule*d’isoprène*présente_t_elle*une*isomérie*Z/E*?*justifier*la*réponse*
2. Combien*de*molécule*d’isoprène*serait*nécessaire*à*la*synthèse*du*nérol*?*
3. Quelle(s)*double(s)*liaison(s)*C=C*peut*donner*lieu*à*une*isomérie*Z/E*
4. Sachant*que*le*nérol*est*l’isomère*Z*,*représenter*la*formule*topologique*de*l’isomère*E,*appelé*géraniol.*
Le*linalol*représenté*ci_dessus*lui,*a*une*odeur*de*muguet.**
5. Montrer*que*le*linalol*est*isomère*du*nérol.*De*quel*type*d’isomérie*s’agit_t_il*?*
Exercice'4':'cohésion'des'solides'ioniques'ou'moléculaires':'caractère'polaire'd’une'liaison'ou'd’une'molécule'''
Donnée*:*
*
A)*solides*ioniques*ou*moléculaire*:*
Le*chlorure*de*sodium*NaCl*est*un*solide*ionique**
1. Quel*sont*les*formules*des*ions*que*renferme*le*chlorure*de*sodium*solide*?*justifier*
2. Expliquer*pour*quelle*raison*les*liaisons*qui*assure*la*cohésion*du*chlorure*de*sodium*est*ionique*et*non*
moléculaire*
3. Préciser*si*les*solides*suivants*sont*ioniques*ou*moléculaires*:*Chlorure*de*lithium*LiCl*;*diiode*I2*;*fluorure*
de*sodium*NaF*;*bromure*de*potassium*KBr*;*chlorure*d’hydrogène*HCl*;*dioxygène*O2*.*
B)*molécules*polaires*ou*apolaires*
Les*molécules*de*méthoxyméthane*et*d’éthanol*de*même*
formule*brute*C6H6O*dont*on*donne*les*formule*semi_
développées*ci_contre*sont*deux*solvants*organiques*très*
utilisés*en*chimie.*
*
méthoxyméthane*
*
éthanol*
1. Déterminer,*en*justifiant,*les*géométries*des*liaisons*établies*par*l’atome*d’oxygène*dans*ces*deux*
composés*
2. Indiquez*sur*un*schéma**si*les*liaisons*établies*par*l’atome*d’oxygène*sont*polarisée*ou*non**
3. Indiquer*sur*un*schéma*si*ces*deux*molécules*sont*polaires*ou*apolaires.*
'
1
/
2
100%