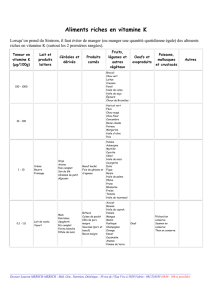
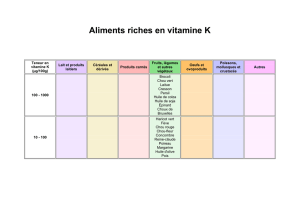
concours 2010 olympiades corrigé

Académie de Rennes/ Brest
Olympiades de chimie 2009-2010
Chimie, Agro-Ressources
Concours Durée : 2h45
Nom :
Prénom :
Lycée : Série :
Les questions sont indépendantes. Les réponses (pas de calculs sur la feuille) doivent être données dans les
emplacements prévus à cet effet sans trop de développement et les calculatrices sont autorisées.
PARTIE I : LES BIOCARBURANTS
I. Chimie et développement durable
1.
Qu’est ce que le développement durable.
un développement qui répond aux besoins des générations du présent sans compromettre la capacité des
générations futures à répondre aux leurs. Deux concepts sont inhérents à cette notion : le concept de
« besoins », et plus particulièrement des besoins essentiels des plus démunis à qui il convient d’accorder la
plus grande priorité, et l’idée des limitations que l’état de nos techniques et de notre organisation sociale
impose sur la capacité de l’environnement à répondre aux besoins actuels et à venir
[2 points]

2 Comment peut-on définir un biocarburant ?
les biocarburants sont des carburants d'origine végétale issus de la biomasse (ensemble des énergies
provenant de la dégradation de la matière organique produite à partir de l'énergie solaire transformée par
les plantes chlorophylliennes d'où le surnom de « carburants verts »). On les produit à partir de déchets
végétaux ou de plants cultivés dans ce but. Ils possèdent des propriétés similaires au pétrole et peuvent
parfois s'employer dans des moteurs diesel ou des moteurs à essence ; ils se substituent partiellement ou
totalement (ex : avec les HVP, la terminologie européenne est « huile végétale pure ») aux carburants
pétroliers, notamment pour faire rouler les véhicules équipés d'un moteur Flex Fuel (ou « polycarburant »).
Les biocarburants ne doivent pas être confondus avec les biocombustibles. Les premiers servent à
alimenter un moteur, tandis que les seconds servent à produire de la chaleur. Aujourd'hui les principaux
biocarburants, en terme de production, sont le bioéthanol et le biodiesel.
[2 points]
3.
Les agro ressources contiennent, en grande quantité, des molécules carbonées, le plus souvent non
toxiques, biodégradables et polyfonctionnelles.
Une première catégorie de produits issue de ces agro ressources est constituée de polysaccharides.
Citer deux exemples de produits chimiques faisant partie des polysaccharides.
Amidon
Cellulose
[1 points]
4
. Des polysaccharides peuvent être extraits du blé.
Citer deux autres exemples de plantes dont sont extraits des polysaccharides.
Maïs
Betteraves
[1 points]
5. Citer une autre catégorie de produits faisant partie des agro ressources et conduisant, entre autres, au
diester.
Triglycerides issus d’oléagineux
[1 points]

II. Biocarburants et effet de serre
.
Influence des biocarburants sur l’effet de serre
Cocher la bonne case
1. Les
biocarburants : L’augmentent
Le laissent pratiquement inchangé
Le diminuent
2.
Justifier la réponse précédente
[1 points]
3. Donner l’équation de la synthèse chlorophyllienne en notant C
6
(H
2
O)
6
le
sucre formé.
C
6
(H
2
O)
6
+ 6 O
2
= 6CO
2
+ 6O
2
[1 points]
III. Synthèse d’un diester.
La transestérification permet de transformer un alcool et un ester ( « naturel », présent dans l’huile
de colza) en un autre
ester ( ici le biocarburant parfois appelé diester) et un autre alcool ( ici, le glycérol ).
Un acide ou une base est souvent utilisé comme catalyseur
Equation de la transestérification
:
O C R
O C R
O C R
O
O
O
+
=
OH
OH
OH
+
glycérol
on considèrera que l’huile de colza est constituée uniquement de trioléate de glycéryle
( triester formé à partir de glycérol et d’acide oléique ).
L’acide oléique (acide (Z) octadéc-9-ènoïque) de formule brute C
18
H
34
O
2
a pour formule
topologique
:
3 Ethanol
=
R= C
17
H
33
3 EEC

1 Vrai ou Faux ?
A Le biodiesel, biogazole (en France, on parle aussi de Diester® qui est une marque déposée, par
contraction des mots diesel et ester), est un carburant obtenu à partir d'huile végétale ou animale
transformée par un procédé chimique appelé transestérification
Faux
B La transformation des huiles ou des graisses en esters éthyliques permet de réduire la viscosité
Vrai
[1 points]
2
Donner les formules brute et semi-développée de l’éthanol.
CH
3
-CH
2
-OH C
2
H
6
O
[1 points]
3. Citer un autre alcool utilisé pour réaliser une transestérification des huiles végétales.
Butanol
[1 points]
4.
Ecrire les formules brute et semi-développée du glycérol. Identifier ses fonctions et donner son
nom en nomenclature officielle.
OH
OH
O
H
C
3
H
8
O
3
Propan-1,2,3-triol
[1 points]

5.
En déduire la formule de L’EEC.
[1 points]
6.
Après avoir rappeler la définition d’un catalyseur, citer un catalyseur utilisé lors d’une
transestérification.
Un catalyseur est une espèce n’intervenant pas dans la réaction mais qui permet d’accélérer la
réaction.
[1 points]
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%