Formation de Solutions Aqueuses

Formation de Solutions Aqueuses
Dissolution d’une Espèce Chimique
!
"
#
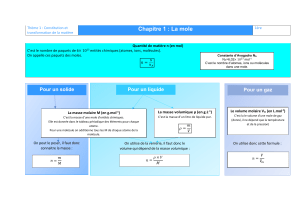
Solution=Soluté +Solvant
Nature de la Solution
$ Le Soluté est un Cristal Ionique
%
NaC l(s)
&
' '
%()*&
+
,%
(&
-
) ! (! .
(
−¿
C l(aq )
¿
/ Le Soluté est Moléculaire
C12 H22 O11
)
C12 H22 O11(aq )
Préparation d’une solution aqueuse
Etape 1 :

0
1
1
Etape 2 : 2#*
Etape 3 : 2 #
2
3
%
&
Etape 4 : ###*
1
/
2
100%