La spectrométrie de masse en tandem appliquée au dépistage

La spectrométrie de masse en tandem
appliquée au dépistage néonatal
des maladies héréditaires du métabolisme :
le point sur les utilisations actuelles
D. Cheillan
S. Cognat
C. Vianey-Saban
I. Maire
C. Dorche
Service de biochimie pédiatrique,
Hôpital Debrousse, Lyon
Article reçu le 9 octobre 2003,
accepté le 9 décembre 2003
Résumé. Les évolutions récentes de la spectrométrie de masse en tandem
permettent actuellement le diagnostic de plus de vingt maladies héréditaires du
métabolisme, à partir d’une seule tache de sang déposé sur papier. Il est ainsi
techniquement possible de réaliser un dépistage néonatal de la plupart des
déficits de la b-oxydation mitochondriale des acides gras, de quelques acidu-
ries organiques et des principales amino-acidopathies et déficits du cycle de
l’urée. De nombreuses études pilotes prospectives de dépistage néonatal utili-
sant cette technologie ont été instaurées à travers le monde depuis ces trois
dernières années. Devant les enjeux techniques, économiques, médicaux et
éthiques que ces applications représentent, cette revue propose de faire un
point sur la spectrométrie de masse en tandem ainsi qu’une synthèse des
résultats des principales études internationales.
Mots clés : maladie héréditaire du métabolisme, dépistage néonatal,
spectrométrie de masse en tandem
Summary. The recent evolution of tandem mass spectrometry allows to dia-
gnose more than twenty inherited metabolic diseases within a single blood
spot. Nowadays, it is technically possible to screen newborns for most of fatty
acid oxydation, organic acid and amino acid disorders. An important number of
prospective pilot studies, using tandem mass spectrometry, have been done
worldwide. However, several technical, economical, medical and ethical pro-
blems are raised by these applications. This review is intended to focus on this
technology and to resume results from the main international studies.
Key words: inherited metabolic disease, neonatal screening, tandem mass
spectrometry
Le dépistage néonatal des maladies héréditaires du méta-
bolisme a été initié dans le milieu des années 1960 avec
les travaux de Robert Guthrie sur la phénylcétonurie [1].
Au-delà de sa technique de mesure de la phénylalanine, le
procédé de prélèvement de sang sur papier buvard a per-
mis une application du dépistage au plus grand nombre.
Les programmes de dépistage néonatal ont connu un essor
considérable à travers le monde tout en diversifiant les
pathologies recherchées.
En France, actuellement, cinq maladies sont recherchées
systématiquement à la naissance : la phénylcétonurie,
l’hypothyroïdie congénitale, l’hyperplasie congénitale des
surrénales, la drépanocytose (dans certaines populations à
risque) et la mucoviscidose. Durant ces trente dernières
années, le principe de base qui a prévalu dans la mise en
place de tout nouveau programme de dépistage a été : une
analyse ou un paramètre pour chaque maladie.
Les évolutions techniques récentes de la spectrométrie de
masse en tandem (MS/MS) vont probablement révolution-
ner dans le futur le monde du dépistage néonatal. En effet,
cette nouvelle technologie permet, à partir d’une seule
tache de sang, de mesurer différents métabolites dont les
Tirés à part : D. Cheillan
revue générale abc
Ann Biol Clin 2004, 62 : 269-77
Ann Biol Clin, vol. 62, n° 3, mai-juin 2004 269
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

acylcarnitines et les acides aminés sanguins. Le diagnostic
de plus de vingt maladies héréditaires du métabolisme est
ainsi possible. Les programmes de dépistage prospectifs
intégrant la MS/MS ainsi que de nouveaux développe-
ments se multiplient dans de nombreux pays laissant à
penser que la MS/MS sera un outil indispensable pour le
dépistage néonatal de demain [2, 3].
La spectrométrie de masse en tandem
Parmi les méthodes analytiques, la spectrométrie de masse
possède de nombreuses qualités dont sa spécificité, sa
grande sensibilité et la grande variété de ses applications.
Le principe de base de toutes les techniques de spectromé-
trie de masse est l’analyse qualitative et quantitative d’un
mélange complexe en séparant les molécules (préalable-
ment ionisées) en fonction de leur rapport masse/charge
(m/z) [4].
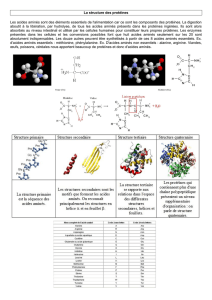
Composition
d’un spectromètre de masse en tandem
Un spectromètre de masse en tandem est composé d’une
source permettant d’ioniser les substances d’intérêt, d’un
analyseur comportant trois quadripôles en série et d’un
détecteur couplé à un système informatique (figure 1).
Les sources d’ionisation
Les sources sont destinées à ioniser les substances à analy-
ser par MS/MS. Dans le domaine de la biologie, les sour-
ces les plus utilisées sont le FAB (fast atom bombarde-
ment), l’ESI (electrospray ionisation) et le MALDI
(matrix assisted laser desorption ionisation). Actuelle-
ment, le FAB n’est plus très répandu car il ne permet pas
l’introduction automatisée d’échantillons. L’ESI est utilisé
pour l’étude des petites molécules en milieu liquide et le
MALDI pour l’étude des protéines. L’électrospray est pro-
duit par application à pression atmosphérique d’un fort
champ électrique sur un liquide traversant un tube capil-
laire avec un faible débit (1 à 10 µL/min). À la sortie du
capillaire, il se forme des gouttelettes hautement chargées
dont le solvant s’évapore peu à peu. Les gouttelettes subis-
sent alors une cascade de fissions aboutissant à la désorp-
tion des ions. Les ions en phase gazeuse sont dirigés dans
l’analyseur par une série de lentilles électromagnétiques.
Il est possible de produire des ions chargés positivement
(ionisation en mode positif) ou des ions chargés négative-
ment (ionisation en mode négatif). Le choix du mode
d’ionisation est réalisé en fonction de la structure chimi-
que de la substance d’intérêt : une molécule donnant pré-
férentiellement des ions positifs ou des ions négatifs.
Les analyseurs et le détecteur
L’analyseur est formé de plusieurs quadripôles placés en
série (3 en général). Un quadripôle est constitué de quatre
électrodes de section hyperbolique où est appliqué un
champ électrique constant et un champ électrique alterna-
tif. Dans ce quadripôle, la stabilité de la trajectoire d’un
ion soumis à ces champs électriques va être dépendante de
sa masse et de sa charge. Il est ainsi possible de séparer les
différents ions d’un mélange complexe en fonction de leur
ratio masse/charge (m/z) [4]. Dans un spectromètre de
masse en tandem, le premier quadripôle (Q
1
) isole l’ion
parent de la molécule d’intérêt à partir d’un mélange com-
plexe. Cet ion sélectionné est fragmenté dans une cellule
de collision (deuxième quadripôle, Q
2
) pour donner des
ions produits et des fragments neutres caractéristiques de
la substance d’intérêt. Enfin, un troisième quadripôle (Q
3
)
analyse les ions produits. Les données sont ensuite re-
cueillies par un détecteur (en général un multiplicateur
d’électrons) formant un courant électrique amplifié
converti par un système informatique en spectres de masse
directement exploitables par l’utilisateur.
Les différents modes d’utilisation
d’un spectromètre de masse
L’analyse en MS/MS peut se faire selon quatre modes
différents en fonction des molécules à étudier (figure 2).
Le balayage des ions fragments (product ion scan)
Cette approche consiste à injecter un échantillon, à sélec-
tionner un ion précurseur correspondant à la molécule
d’intérêt dans Q
1
, à le fragmenter en Q
2
et à déterminer
tous les ions produits en Q
3
. Ce mode est utilisé pour
identifier une substance inconnue dans un mélange com-
plexe.
Le balayage des ions parents (precursor ion scan)
Ce mode consiste à sélectionner un ion fragment en Q
3
et
à balayer en Q
1
tous les ions parents donnant cet ion fils
après fragmentation. Ce mode est utilisé pour identifier
une famille de molécules ayant une partie de leur structure
similaire (par exemple, obtenir le profil des acylcarniti-
nes).
Le balayage en perte neutre (neutral loss scan)
Ce mode consiste à choisir un fragment neutre et à détec-
ter toutes les fragmentations provoquant la perte de ce
Q3D
D
SQ1Q2
m/z
Q3D
D
SQ1Q2
Échantillon
Source
d'ionisation Analyseur Détecteur
Abondance
Figure 1. Schéma d’un spectromètre de masse en tandem. Q
1
,
Q
2
et Q
3
représentent les trois quadripôles placés en série qui
composent l’analyseur.
revue générale
Ann Biol Clin, vol. 62, n° 3, mai-juin 2004270
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

fragment. De la même façon que le mode précédent, il est
possible d’identifier une famille de molécules partageant
une structure chimique similaire. Une des applications de
ce mode est le dosage semi-quantitatif des acides aminés.
Le multi reaction monitoring (MRM)
Ce mode permet de trier une ou plusieurs molécules ayant
un ion précurseur et un ion fragment spécifique. On ob-
tient ainsi des couples ions parents/ions fils très spécifi-
ques d’une molécule. En utilisant ce mode, il est possible
de quantifier simultanément de très nombreux composés
ayant des structures chimiques différentes.
Les performances de la MS/MS
La MS/MS offre la possibilité d’analyser des grandes sé-
ries tout en conservant une bonne sensibilité et une grande
spécificité rendant possible le dosage de nombreux méta-
bolites sur de faibles quantités de prélèvement. Les appa-
reils ont la capacité de travailler en injection directe ou
bien associés à une étape de chromatographie liquide si
une séparation est requise [5]. Dans les deux cas de figure,
les temps d’analyse sont extrêmement réduits. Par exem-
ple, le dosage de la phénylalanine sur un échantillon peut
prendre 2 heures avec une technique fluorimétrique et
moins de 2 minutes par MS/MS.
Il reste cependant des limites surtout représentées par les
étapes préparatives de l’échantillon qui peuvent être assez
longues et fastidieuses (étapes d’extraction, de purifica-
tion...). La grande complexité de la matrice plasmatique
est souvent responsable d’une importante « extinction chi-
mique » diminuant l’ionisation et donc la sensibilité de la
technique. Enfin, l’interprétation des données nécessite un
personnel qualifié ayant un niveau d’expertise élevé et ce
a fortiori dans le domaine des maladies héréditaires du
métabolisme.
Les applications de la MS/MS
au diagnostic des maladies héréditaires
du métabolisme
Deux applications de la MS/MS ont permis d’améliorer le
diagnostic des maladies héréditaires du métabolisme : le
profil des acylcarnitines et le dosage semi-quantitatif des
acides aminés. La première permet de faire le diagnostic
des déficits de l’oxydation mitochondriale des acides gras
et de certaines aciduries organiques. La seconde permet
pour sa part de diagnostiquer des amino-acidopathies et
des déficits du cycle de l’urée. L’apport fondamental de la
MS/MS pour ces deux groupes de techniques est la possi-
bilité de les réaliser simultanément en quelques minutes
sur de faibles quantités de prélèvement comme une tache
de sang déposé sur papier. Le temps d’analyse pour une
microplaque de 96 puits est d’environ cinq heures (soit
trois minutes par échantillon) auquel il faut ajouter trois
heures de préparation préanalytique. Les principales mala-
dies héréditaires du métabolisme pouvant être diagnosti-
quées par MS/MS sont données dans le tableau I.
Le profil des acylcarnitines
La carnitine est une petite molécule issue de la lysine
permettant de détoxifier les acyl-CoA qui s’accumulent
dans la mitochondrie sous forme d’acylcarnitines. Dans la
plupart des déficits de la b-oxydation mitochondriale des
acides gras ainsi que de nombreuses aciduries organiques,
ce mécanisme est amplifié car les acyl-CoA ne peuvent
plus être métabolisés. Le profil des acylcarnitines et la
mesure de la carnitine libre dans un échantillon biologique
permettent ainsi le diagnostic de ces déficits [7].
Méthode de détermination
du profil des acylcarnitines par MS/MS
Le protocole est similaire quels que soient les équipes et
les appareils utilisés. Les acylcarnitines sont extraites à
partir d’une tache de sang déposé sur papier puis dérivées
M+M+F+
+++
M+
M1+
M2+
Mn+
M1+ -N
M2+ -N
Mn+ -N
Fn+
M+M+F1+
F2+
M++
M1+
M2+
Mn+
+
++
F+
Q3D
D
SQ1Q2Q3D
D
SQ1Q2
Q3D
D
SQ1Q2Q3D
D
SQ1Q2
Q3D
D
SQ1Q2Q3D
D
SQ1Q2
Q3D
D
SQ1Q2Q3D
D
SQ1Q2
Sélectionne un ion M
+
au niveau de Q1, le fragmente en Q2
et balaye les ions formés F
+
au niveau de Q3
Balayage des ions fragments
Balaye en Q1 les ions M+ donnant le même ion F+ sélectionné
en Q3 après fragmentation dans Q2
Balaye en Q1 tous les ions M+ perdant une masse donnée (N)
après fragmentation en Q2
Sélectionne un ion M+ donnant un ion fragment ou une perte neutre spécifique
Balayage des ions parents
Balayage des pertes neutres
MRM : multi reaction monitoring
Figure 2. Principaux modes d’utilisation de la MS/MS.
Spectrométrie de masse en tandem
Ann Biol Clin, vol. 62, n° 3, mai-juin 2004 271
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

sous forme d’esters butyliques, ce qui augmente la sensi-
bilité. Les échantillons sont ensuite injectés directement
dans l’appareil.
Toutes les acylcarnitines butylées donnent un ion de masse
85 Da après fragmentation. Le profil est obtenu en sélec-
tionnant tous les ions parents donnant cet ion 85 Da (mode
d’analyse en balayage des ions parents). La quantification
est obtenue en utilisant comme étalons internes des acyl-
carnitines marquées par des isotopes stables (
2
Hou
13
C).
Chaque pathologie à l’origine d’une accumulation d’acyl-
carnitines donnera ainsi un profil caractéristique qui per-
mettra d’évoquer un diagnostic [8].
Les déficits de la b-oxydation mitochondriale
Le rôle de la b-oxydation mitochondriale des acides gras
est de produire de l’énergie sous forme d’acétyl-CoA en
relais de la glycolyse dans les épisodes de stress et de
jeûne prolongé. Les acides gras proviennent de la lipolyse
dans les adipocytes (acides gras à longue chaîne) et de
l’alimentation (acides gras à chaîne longue, moyenne et
courte). Ils sont captés principalement par les muscles, le
foie et le cœur, puis pénètrent dans la mitochondrie pour y
être oxydés. Les acides gras à chaîne moyenne et courte
entrent directement dans la mitochondrie alors que ceux à
chaîne longue entrent sous forme d’acylcarnitines à l’aide
Tableau I. Maladies héréditaires du métabolisme pouvant être diagnostiquées par MS/MS sur un prélèvement de sang déposé sur
papier.
Groupe/maladies Technique MS/MS Fréquence Amélioration
sous traitement
Amino-acidopathies
Phénylcétonurie AA PN 102 1/14 000
(a)
Oui
Leucinose AA PN 102 1/185 000
(a)
Oui
Homocystinurie AA PN 102 1/200 000-335 000
(a)
Oui
Tyrosinémie I, II AA PN 102 1/100 000-120 000
(a)
Oui
Hyperglycinémie sans cétose AA MRM 1/200 000
(b)
Non
Déficits du cycle de l’urée
Citrullinémie AA PN 119 1/57 000
(a)
Oui
Acidurie argininosuccinique AA MRM 1/70 000
(a)
Oui
Argininémie AA PN 119 1/363 000
(a)
+/–
Aciduries organiques
Acidurie propionique AC 1/87 000-137 000
(a)
Oui
Acidurie isovalérique AC ND (> 200 cas
(b)
) Oui
Acidurie méthylmalonique AC 1/48 000-61 000
(b)
Oui
Acidurie glutarique de type I AC 1/50 000
(b)
+/–
Déficit en acétoacétyl-CoA thiolase mitochondriale AC ND (> 50 cas
(b)
) Oui
Déficit en 3-méthylcrotonyl-CoA carboxylase AC ND (> 25 cas
(b)
) Oui
Déficit en 3-hydroxy-3-méthylglutaryl-CoA lyase AC ND (> 50 cas
(b)
) Oui
Déficits de la -oxydation des acides gras
Déficit de transport en carnitine AC ND (> 100 cas
(b)
) Oui
Déficit en carnitine palmitoyl transférase I AC ND (> 30 cas
(b)
) +/–
Déficit en carnitine palmitoyl transférase II AC ND (> 200 cas
(b)
) +/–
Déficit en carnitine-acylcarnitine translocase AC ND (> 50 cas
(b)
) +/–
Déficit en acyl-CoA déshydrogénase des AG à très longue chaîne AC ND (> 200 cas
(b)
) +/–
Déficit en 3-hydroxy acyl-CoA déshydrogénase des AG à chaîne
longue ou en protéine trifonctionnelle mitochondriale
AC ND (> 200 cas
(b)
) +/–
Déficit en acyl-CoA déshydrogénase des AG à chaîne moyenne AC 1/15 000-100 000
(a)
Oui
Déficit en acyl-CoA déshydrogénase des AG à chaîne courte AC ND (> 50 cas
(b)
) +/–
Déficit multiple en acyl-CoA déshydrogénase AC ND (> 200 cas
(b)
) +/–
AA PN102 : dosage semi-quantitatif des acides aminés en mode perte neutre de 102 Da ; AA PN119 : dosage semi-quantitatif des acides aminés
dibasiques en mode perte neutre de 119 Da ; AA MRM : dosage spécifique d’un acide aminé en mode multi reaction monitoring ; AC : profil des
acylcarnitines ; AG : acides gras ; +/– : dans l’état actuel de la prise en charge thérapeutique, le traitement apporte un bénéfice réel pour l’enfant maisne
corrige pas complètement tous les symptômes de la maladie ; (a) Les fréquences ont été obtenues dans [6] ; (b) ND : non déterminé, les chiffres
représentent la somme des données de la littérature et de notre expérience personnelle.
revue générale
Ann Biol Clin, vol. 62, n° 3, mai-juin 2004272
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

d’enzymes de la membrane mitochondriale (carnitine pal-
mitoyl transférase I/II et carnitine-acylcarnitine translo-
case). Dans la matrice mitochondriale, les acides gras sous
forme d’acyl-CoA sont oxydés par des enzymes spécifi-
ques de la taille de leur squelette carboné. Les acétyl-CoA
formés pourront alors être directement utilisés par la mito-
chondrie pour former des corps cétoniques et être exportés
pour fournir de l’énergie au cerveau et aux muscles. Dans
les déficits de la b-oxydation mitochondriale (défauts de
transport membranaire des acylcarnitines ou déficits en
enzymes de la b-oxydation), les acyl-CoA s’accumulent
dans la mitochondrie et sont éliminés sous forme d’acyl-
carnitines permettant le diagnostic de ces maladies [9].
L’expression clinique de ces maladies est celle d’un déficit
énergétique se révélant soit par une hypoglycémie hypo-
cétotique, soit par une cardiomyopathie hypertrophique,
soit par une atteinte musculaire de type faiblesse muscu-
laire ou rhabdomyolyse. Le traitement repose sur l’évic-
tion des périodes de jeûne prolongé associé à une supplé-
mentation en carnitine et en triglycérides à chaîne moyenne
pour les déficits de la b-oxydation des acides gras à chaîne
longue.
Les aciduries organiques
La plupart des acides organiques proviennent du catabo-
lisme des acides aminés ramifiés (leucine, isoleucine, va-
line) produisant de l’acétyl-CoA ou du succinyl-CoA ren-
trant dans le cycle de Krebs. De nombreuses enzymes
peuvent être déficientes et entraîner l’accumulation du pré-
curseur qui s’élimine ensuite sous forme d’acide(s) orga-
nique(s) dans le sang puis les urines. Les aciduries organi-
ques les plus fréquemment diagnostiquées sont les
aciduries propionique, isovalérique, et méthylmalonique.
D’autres aciduries sont retrouvées plus rarement comme
le déficit en 3-hydroxy-3-méthylglutaryl-CoA lyase et le
déficit en 3-méthylcrotonyl-CoA carboxylase. Clinique-
ment, ces maladies se présentent sous trois formes distinc-
tes : néonatale sévère, chronique intermittente et chroni-
que progressive. Les acides organiques accumulés peuvent
être éliminés directement ou couplés soit avec de la gly-
cine (sous forme d’acylglycines) soit avec de la carnitine
(sous forme d’acylcarnitines) [10].
Outre le catabolisme des acides aminés ramifiés, le cata-
bolisme du tryptophane et de la lysine peut aussi être
touché par des déficits enzymatiques conduisant à des at-
teintes neurologiques sévères dont la plus fréquente est
l’acidurie glutarique de type I [11].
Enfin, parmi les troubles de la cétolyse, le déficit en
acétoacétyl-CoA thiolase mitochondriale peut être dia-
gnostiqué par MS/MS grâce au profil des acylcarnitines.
Pour toutes ces maladies, le principe général du traitement
est un régime hypoprotidique afin de limiter l’apport du ou
des acides aminés en cause, associé à une complémenta-
tion en acides aminés essentiels, en vitamines, en miné-
raux et en oligoéléments.
Le dosage semi-quantitatif des acides aminés
La plupart des voies métaboliques impliquant des acides
aminés sont touchées par des déficits enzymatiques qu’il
est possible de diagnostiquer par le dosage des acides
aminés plasmatiques.
L’approche par MS/MS sans séparation préalable ne per-
met pas à l’heure actuelle de doser tous les acides aminés.
Nous n’envisagerons donc que les déficits qu’il est possi-
ble de mettre en évidence avec cette technique sur des
prélèvements de sang déposé sur papier.
La technique classique de dosage des acides aminés est la
chromatographie liquide d’échange d’ions. Le développe-
ment actuel des techniques MS/MS permet de doser un
certain nombre d’acides aminés. Le principe repose sur la
même préparation des échantillons que pour les acylcarni-
tines : les acides aminés sont extraits à partir d’un tache de
sang puis dérivés par butylation avant d’être introduits
dans l’appareil. Le mode d’analyse est en revanche diffé-
rent. Après fragmentation, la majorité des acides aminés
donnent un même fragment neutre de masse 102 Da (ala-
nine, sérine, proline, valine, glutamine + acide glutami-
que, leucine + isoleucine + alloisoleucine, méthionine,
histidine, phénylalanine, tyrosine, asparagine + acide as-
partique). Les acides aminés basiques (citrulline, lysine,
arginine, ornithine) donnent un fragment neutre de masse
119 Da. Le profil des acides aminés est obtenu en sélec-
tionnant tous les ions parents donnant une perte de masse
de 102 Da ou de 119 Da après fragmentation (mode d’ana-
lyse en balayage des pertes neutres). La glycine et l’acide
argininosuccinique sont dosés individuellement en mode
MRM.
La quantification est obtenue en utilisant comme étalons
internes des acides aminés marqués par des isotopes sta-
bles (
2
Hou
13
C). Le dosage des acides aminés par cette
technique reste cependant semi-quantitatif. En effet, il est
impossible de mesurer individuellement les acides aminés
isomasse comme la leucine, l’isoleucine et l’alloisoleu-
cine et l’on ne peut mesurer que la somme de ces trois
acides aminés. De plus, lors de l’étape de dérivation, la
glutamine et l’asparagine se transforment respectivement
en acide glutamique et en acide aspartique ne rendant
possible que la mesure de la somme acide glutamique +
glutamine et la somme acide aspartique + asparagine.
Les aminoacidopathies
et les déficits du cycle de l’urée
Les déficits enzymatiques à l’origine de ces pathologies
entraînent une accumulation d’un ou plusieurs métabolites
devenant toxiques pour l’organisme. Toutes ces maladies
sont traitables par un régime d’exclusion du ou des acides
Spectrométrie de masse en tandem
Ann Biol Clin, vol. 62, n° 3, mai-juin 2004 273
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%