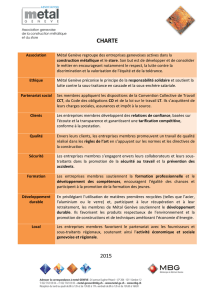
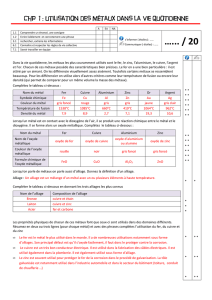
Évaluation sommative

1
TEST PRATIQUE SNC2D
Partie A Choix multiples. Encercle la meilleure réponse seulement.
(8 minutes)
1. Quelle paire d’ions a le même nombre d’électrons?
a) Ca 2+ et Br –
b) Ca 2+ et Mg 2+
c) Na + et F –
d) Mg 2+ et F –
e) Li + et He
2. Quel est le nombre total d’atomes dans la formule Au(NO3)3 :
a) 5
b) 7
c) 10
d) 11
e) 13
3. Quand l’équation chimique est correctement balancée, quelle est la
valeur de x?
xCr + yO2 zCr2O3
a) 1
b) 2
c) 3
d) 4
e) 5

2
4. Parmi les substances suivantes, lesquelles sont probablement des
électrolytes? En autre mots, lesquelles en forme aqueuse pourraient faire
allumer l’ampoule ci-dessous?
a) C3H8 et l’antigel
b) L’antigel et l’acide benzoïque
c) Le chlorure de sodium et le KBr
d) Le NaCl et le butane
e) Le propane et H2
5. Quelles observations parmi les suivantes ne sont pas une preuve d’une
transformation chimique?
a) La solution est devenue chaude.
b) Le réactif solide s’est dissous dans le solvant.
c) La solution est devenue bleue.
d) De l’oxygène gazeux s’est formé. Des bulles se sont échappées
de la solution.
e) Aucune de ces réponses.
Partie B Questions à réponses courtes. (22 minutes)
6. Les voitures brûlent de l’octane. (4/22 min)
a) Donne l’équation chimique squelette de cette réaction. Ajoute les
états et respects la loi de la conservation de l’énergie.

3
b) Le monoxyde de carbone, un gaz toxique, réagit lentement avec
l’oxygène et produit du dioxyde de carbone. Cette réaction est très
rapide en présence de rhodium métallique (Rh). Quel est le rôle de ce
métal?
________________________________________________________________
________________________________________________________________
7. Écris l’équation chimique balancée et indique le type de réaction dont il
s’agit. Ensuite ajoute les états des composés et des éléments.
(10/22 min)
a) Le sodium réagit avec l’eau et produit de l’hydroxyde de sodium et de
l’hydrogène gazeux.
b) Le sulfate de cuivre (II) réagit avec du nickel et forme du sulfate de
nickel (II) et du cuivre métallique.
c) Le phosphate de potassium et l’iodure de magnésium réagissent en
solution aqueuse. C’est une réaction de déplacement double qui
produit un précipité.
________________________________________________________
8. Définis deux des quatre termes suivants en phrases complètes en te
servant du vocabulaire précis. Utilise des exemples concrets pour illustrer ta
définition. (3/22 min)
Indicateur, pourcentage d’ionisation, concentration, catalyseur
1.
______________________________________________________________
______________________________________________________________
______________________________________________________________

4
______________________________________________________________
______________________________________________________________
2. ______________________________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
9. Dis si chacune des situations suivantes est acide, basique ou
neutre (Indiques toutes les bonnes réponses possibles.) : (3/22 min)
a) une solution qui reste incolore quand on y ajoute de la phénolphtaléine;
_________________
b) une solution dans laquelle le papier de tournesol bleu devient rouge;
__________________
c) une solution qui contient des concentrations et des volumes égales d’acide
sulfurique et d’hydroxyde de sodium; ________________________
d) Une tablette d’antiacide dissoute dans un verre d’eau; _________________
10. Indique le type de chacune de ces équations chimiques. (2/22 min)
a) S8 (s) + O2 (g) SO2 (g) ____________________________
b) HF (g) H2 (g) + F2 (g) ____________________________
c) H2SO4 (aq) + NaOH (aq) Na2SO4 (aq) + H2O (l)
______________________________

5
Partie C Pratique expérimental et processus scientifique.
(15 minutes)
11. Lors d’un laboratoire de neutralisation ton partenaire renverse une substance
inconnue. Tu te portes volontaire à nettoyer la substance en sécurité.
Explique ta méthode en style télégraphique à l’aide de diagramme. (5/15 min)
12. En laboratoire tu as effectué l’expérience suivante. (10/15 min)
But :
Déterminer la série de réactivité des métaux.
Hypothèse :
Les solutions qui forment un précipité en présence d’un métal particulier ont subit
une réaction chimique de déplacement simple; le métal solide doit être considéré
plus réactif que le métal en solution. Dans l’absence d’une réaction chimique le
métal de la solution est plus réactif que le métal en forme solide.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%