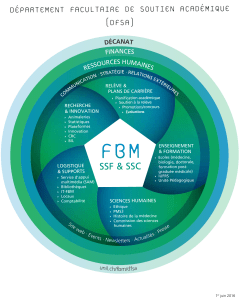
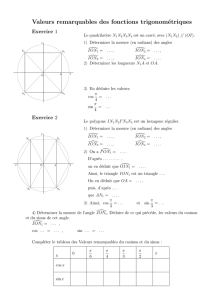
Chimie : Les Complexes Inorganiques - Cours Lycée

Term STL SPCL –Lycée Ste Anne- Verdun B. CHIOMENTO
Chimie et développement
durable
COURS : LES COMPLEXES
DES SYNTHESES
INORGANIQUES
Objectifs :
- Reconnaître dans un complexe : l'ion ou l'atome central, le ou les ligands, le caractère monodenté ou polydenté du ligand.
- Décrire l'établissement de la liaison entre l'ion ou l'atome central et le ou les ligands selon le modèle accepteur-donneur de doublet
électronique.
- Écrire l'équation de la réaction associée à la synthèse d'un complexe.
- Suivre un protocole de synthèse d'un complexe.
- Déterminer, à l'aide d'un tableau d'avancement, le réactif limitant dans la synthèse d'un complexe et en déduire le rendement de la
synthèse.
- Proposer ou suivre un protocole mettant en œuvre l'analyse qualitative et quantitative d'un complexe.
- Extraire des informations pour illustrer des applications des complexes inorganiques et bio-inorganiques.
I. Définitions
1. Généralités :
Un complexe
La plupart des ions métalliques peuvent former des complexes mais c’est particulièrement le cas pour ceux des
métaux de transition.
Ainsi l’ion Cu2+ forme dans l’eau un ion complexe [Cu(H2O)4]2+, responsable de la couleur bleue des solutions de
sels de cuivre II.
Les ligands, qui ne sont pas tous nécessairement identiques dans un ion complexe, peuvent être des
comme H2O ou NH3, ou des comme Cl-, Br-, CN-, NO2-…. Des molécules organiques
parfois très complexes peuvent aussi jouer le rôle de ligands.
Lorsqu’un ion s’entoure de ligands pour former un complexe, on parle de
Ces réactions provoquent souvent des changements de couleur, démontrant que les propriétés électroniques
des complexes sont différentes de celles des réactifs de départ.
La charge électrique globale d’un ion complexe est égale
Elle est indiquée à l’extérieur des crochets qui encadrent la formule de l’ion complexe.
On rappelle généralement dans cette formule le nombre d’oxydation de l’ion métallique, égal à la charge qu’il
possédait initialement.
Exemples :
Complexe
Ion central
Ligand(s)
[AgI(NH3)2]+
[HgIICl4]2-
[CoIII(NO2)6]3-
[AlIII(H2O)4(OH)2]+
[PtII(NH3)2Cl2]

Term STL SPCL –Lycée Ste Anne- Verdun B. CHIOMENTO
Remarque : le dernier complexe n’est pas un ion mais une molécule.
L’indice de coordination est .
Il dépend entre autres du rayon de l’ion et de son degré d’oxydation. Les valeurs les plus fréquentes sont 2, 4 et
6 comme dans les exemples d’avant.
2. Différents types de ligands :
Les ligands sont classés selon leur structure et le nombre d’atomes donneurs.
a. ligands monodentés :
Exemples : H2O, NH3, CH3OH, OH- , Cl-
b. ligands bidentés :
Exemple de complexe :

Term STL SPCL –Lycée Ste Anne- Verdun B. CHIOMENTO
c. ligands polydentés :
hexadenté
BILAN :
Remarques :
1. il existe des ligands macrocycliques :
2. Effet chélate :
o Même nature de liaison (covalente de coordination)
o Le deuxième complexe a des ligands polydendates stabilité particulière
K = 3,1.108
K = 1018
Complexe plus stable

Term STL SPCL –Lycée Ste Anne- Verdun B. CHIOMENTO
3. Géométrie d’un complexe : Polyèdre de coordination :
Le polyèdre de coordination est la figure géométrique ayant comme sommets les atomes directement liés
au métal. Quelques exemples courants :
II. Synthèse de complexes : voir TP
III. Dissociation en solution aqueuse :
En solution aqueuse les complexes (composés ioniques cristallisés) sont , mais leur
dissociation laisse intact l’ion complexe.
1
/
4
100%
![[ ][][ MLn L M 10.3,6 ]) ([ ] [] [ = × = NH Ag NH Ag Kd](http://s1.studylibfr.com/store/data/002601672_1-57de8b0d2e37b3f5af3073b29cc142bc-300x300.png)