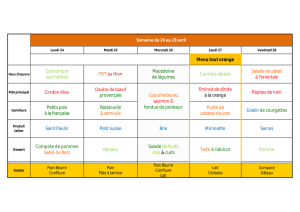
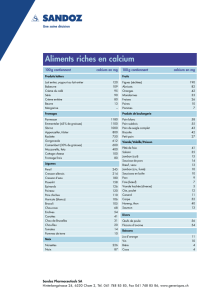
La douleur en mémoire : une "trace" en périphérie come

Quand on se rappelle de sa douleur, on l’éprouve à nouveau,
quand on se rappelle du plaisir, ce n’est qu’un souvenir.
”
Un douloureux chronique
La douleur est une expérience individuelle subjective, comme l’a définie
l’IASP en 1986. Cette expérience unique peut selon les cas, en fonction
du terrain, du moment ou du type de douleur, entraîner des modifications
durables du système nerveux qui vont favoriser le passage à la chroni-
cité, par des modifications de la plasticité neuronale. Les liens entre la
mémoire et la douleur sont mieux connus depuis quelques années, et l’on
a pu montrer par plusieurs observations cliniques que la mémoire de la
douleur échappait en partie aux circuits traditionnels de la mémoire. Si
la douleur du membre fantôme, ou “algohallucinose des amputés”, reste
le tableau dans lequel la mémorisation de la douleur est la plus évidente,
cette mémorisation intervient aussi dans de très nombreux syndromes
douloureux chroniques. Une connaissance des mécanismes et des liens
entre la douleur et la mémoire est nécessaire pour envisager des
approches thérapeutiques curatives, mais aussi préventives, des tableaux
chroniques.
DOULEUR
L
a douleur en mémoire :
une “trace” indélébile en périphérie comme au niveau central
des modifications structurales de la corne
dorsale de la moelle après une stimulation
douloureuse.
La sensibilisation périphérique
et l’hyperalgésie secondaire
Quelques minutes après une stimulation
douloureuse, il se produit une réaction
périphérique autour de la zone stimulée :
c’est l’hyperalgésie secondaire. On trouve
ainsi, dans une zone plus large que la zone
lésée, une allodynie (douleur pour une sti-
mulation normalement non douloureuse)
et une hyperalgésie (douleur ressentie de
façon exagérément intense par rapport à
l’intensité de la stimulation appliquée). La
sensibilisation périphérique induit une
activation des fibres A-delta et C pour des
stimulus habituellement non douloureux,
avec un seuil d’activation diminué.
–Dans l’inflammation aiguë, douleur par
excès de nociception type, la sensibilisa-
tion périphérique est un phénomène très
important. Le pH acide, l’histamine, les
prostaglandines, les leukotriènes, la 5-HT,
la bradykinine, la norépinéphrine... libé-
rés dans le foyer inflammatoire entraînent
une sensibilisation périphérique des récep-
teurs : l’inflammation est un facteur
majeur de mémorisation périphérique de
la douleur. Les cytokines pro-inflamma-
toires (TNFα,IL1ß, IL6, IL8) agissent
comme sensibilisants du système nerveux
au niveau périphérique, mais aussi central.
–Après une lésion nerveuse ou lors d’une
inflammation chronique, des canaux
ioniques neuronaux vont être activés sur
les neurones : ce sont les canaux sodiques
(Na+) résistants à la tétrodotoxine (TTX),
présents dans les fibres amyéliniques de
faible diamètre, qui participent à l’excita-
tion périphérique anormale. Des facteurs
génétiques d’activation de ces canaux
existent, qui peuvent expliquer des varia-
Des mécanismes périphériques
précoces : les oncogènes c-fos
et c-jun
Les études sur la mémoire ont permis
d’identifier des oncogènes, gènes que l’on
pensait seulement liés aux cancers, dans
les neurones activés par de nombreux
types de stimulus. Ainsi, un gène identique
à l’oncogène v-fos (qui induit l’ostéo-
sarcome du chat provoqué par les virus)
permet de visualiser les modifications neu-
ronales après un stimulus transitoire. Ce
gène est un gène constitutif, donc norma-
lement présent dans les neurones, et il est
appelé oncogène c-fos ; c’est un marqueur
précoce de l’activation neuronale.
Après une stimulation douloureuse,
l’équipe de Hunt a montré que l’on pou-
vait retrouver un marquage spécifique
c-fos dans les neurones de la corne dor-
sale de la moelle. Les gènes c-fos et
d’autres gènes comme c-jun sont présents
dans de nombreuses cellules activées par
un stimulus douloureux. L’ARNm du
c-fos, en particulier, est retrouvé dans la
corne dorsale de la moelle quelques
minutes après le développement d’une
inflammation périphérique. L’expression
de c-fos et c-jun est donc la première étape
La Lettre du Rhumatologue - n° 267 - décembre 2000
34
“

DOULEUR
!Arnstein PM. The neuroplastic phenomenon :
a physiologic link between chronic pain and lear-
ning. J Neurosci Nurs 1997 ; 29 : 179-86.
!
Eich E, Reeves JL, Jaeger B, Graff-Radford SB.
Memory for pain : relation between past and pre-
sent pain intensity. Pain 1985 ; 23 : 375-9.
!Ghoneim MM, Block RI. Learning and
memory during general anesthesia : an update.
Anesthesiology 1997 ; 87 : 387-410.
!Kalso E. Memory for pain. Acta Anaesthesiol
Scand Suppl 1997 ; 110 : 129-30.
!Katz J, Melzack R. Pain “memories’in phan-
tom limbs : review and clinical observations.
Pain 1990 ; 43 : 319-36.
!Ornstein PA, Manning EL, Pelphrey KA. Chil-
dren’s memory for pain. J Dev Behav Pediatr
1999 ; 20 : 262-77.
!Price DD. Psychological and neural mecha-
nisms of the affective dimension of pain. Science
2000 ; 288 : 1769-72.
!Storzbach D, Campbell KA, Binder LM et al.
Psychological differences between veterans with
and without Gulf War unexplained symptoms.
Psychosom Med 2000 ; 62 : 726-35.
!Wall PD. The prevention of postoperative pain.
Pain 1988 ; 33 : 289-90.
Pour en savoir plus...
tions d’activité (selon le sexe, l’âge, le ter-
rain...). Les facteurs neurotrophiques
comme le NGF ou le BDNF agissent aussi
comme des neuromodulateurs des neu-
rones nocicepteurs.
La sensibilisation centrale est
un élément majeur dans la
pérennisation des circuits de la
douleur
La sensibilisation centrale implique la
mise
en jeu d’un nombre important de neuro-
transmetteurs. L’activation périphérique
des fibres A-delta et C par une stimulation
douloureuse va induire une activation post-
synaptique plus longue et plus importante
dans le cas d’une sensibilisation centrale.
Cette amplification centrale est liée à l’ac-
tivation de récepteurs N-methyl-D-aspar-
tic acid (NMDA) par des acides aminés
excitateurs comme le glutamate et à l’ac-
tivation de récepteurs neurokinines par la
substance P. Le monoxyde d’azote, ubi-
quitaire et impliqué dans de nombreux pro-
cessus, est également très impliqué dans la
sensibilisation centrale due à la douleur.
Lors de certaines stimulations nocicep-
tives, en particulier des douleurs viscérales
ou neuropathiques, on a pu noter une acti-
vation de neurones de la colonne dorsale,
donc de nouvelles voies de transmission
de la douleur, habituellement non fonc-
tionnelles : la mémorisation de la douleur
induit un recrutement temporel, mais aussi
spatial, au niveau central.
Une mémorisation variable
selon la douleur
La mémoire d’une douleur est influencée
par un grand nombre de facteurs, dont en
premier lieu l’intensité de la douleur appli-
quée. Le jugement des patients semble plus
influencé par l’intensité du stimulus que
par sa durée. Différents facteurs peuvent
agir sur la mémoire de la douleur : l’in-
tensité de la douleur, l’émotion, l’intensité
attendue de la douleur, le pic d’intensité
d’autres douleurs précédemment ressen-
ties. De nombreux auteurs ont montré que
si une douleur sévère persistait plus de
24 heures, le développement de modifica-
tions neurologiques était inévitable.
Les facteurs psychologiques
sont fondamentaux
Des modifications neurologiques peuvent
survenir après une douleur, mais aussi
après un choc psychologique. La mémori-
sation des phénomènes douloureux est bien
sûr renforcée par des situations de stress ou
de conflit psychologique. Le cerveau pos-
sède des systèmes pour masquer ou ren-
forcer la douleur grâce aux endorphines, à
la sérotonine et autres médiateurs. La séro-
tonine pourrait être impliquée dans la rémi-
niscence de la douleur au cours de certaines
dépressions. Les facteurs psychologiques
sont au premier plan dans les douleurs
chroniques, où la complexité du tableau ne
permet souvent pas de définir ce qui les a
favorisées ou ce qui en est le corollaire :
états dépressifs, troubles de la personnalité,
anxiété, atteinte du comportement ou du
coping... Les approches cognitivo-com-
portementales insistent aujourd’hui égale-
ment sur l’importance des croyances et des
attentes des patients (douleur attendue
avant une intervention, soulagement espéré
après un traitement), également importantes
dans l’effet placebo.
Peut-on prévenir la mémorisa-
tion de la douleur ? L’analgésie
préventive
En général, la prise en charge de la dou-
leur débute après l’apparition du stimulus
douloureux. Récemment, certains auteurs
ont développé le concept d’analgésie pré-
ventive. De nombreuses études ont en effet
montré que chez l’animal, une interven-
tion antinociceptive appliquée avant un sti-
mulus douloureux ou une lésion est plus
efficace que lorsqu’elle est appliquée après
le stimulus. Par contre, une fois que l’hy-
perexcitabilité est induite, il faut utiliser de
plus larges doses d’antalgiques pour sup-
primer la douleur. Dans la pratique, ce
concept démontré chez l’animal est contro-
versé chez l’homme, et n’a pas prouvé sa
pertinence dans de nombreuses situations,
en particulier en chirurgie. En revanche,
on sait que les traitements qui agissent sur
la mémoire, en particulier les benzodiazé-
pines, mais aussi les cannabinoïdes, ont un
rôle antalgique démontré : ils sont utilisés
comme coanalgésiques dans de nom-
breuses situations.
La mémoire de la douleur, qui compte par-
fois autant que la douleur ressentie par le
patient au moment du traumatisme ou de la
lésion, est un élément fondamental à
prendre en compte, notamment en rhuma-
tologie, où les atteintes chroniques sont pré-
dominantes. Pour certains auteurs, la dou-
leur chronique ne serait qu’une
réminiscence de douleurs aiguës, alors
même que l’agression tissulaire a disparu.
Les facteurs favorisant cette mémoire sont
très nombreux et variables d’un patient à
l’autre. Cette approche nouvelle offre des
perspectives intéressantes pour le traitement
de nombreuses douleurs, avant tout neuro-
pathiques, mais aussi en rhumatologie.
S. Perrot,
service de rhumatologie A
et Centre de traitement de la douleur,
hôpital Cochin-Tarnier, Paris
1
/
2
100%

![21.Francis PONGE : Le parti pris de choses [1942]](http://s1.studylibfr.com/store/data/005392976_1-266375d5008a3ea35cda53eb933fb5ea-300x300.png)