le virus respiratoire syncytial chez la vache laitiere - Thèses

ECOLE NATIONALE VETERINAIRE D’ALFORT
ANNEE 2002
LE VIRUS RESPIRATOIRE SYNCYTIAL
CHEZ LA VACHE LAITIERE
THESE
pour le
DOCTORAT VETERINAIRE
présentée et soutenue publiquement
devant
LA FACULTE DE MEDECINE DE CRETEIL
le
…………………………
par
Arnauld, Olivier, Daniel DURAND
Né le 6 février 1967 à Petit-Quevilly (76)
JURY
Président : ………………………….
Professeur à la Faculté de Médecine de CRETEIL
Membres
Directeur : Mme BRUGERE-PICOUX
Professeur de pathologie médicale du bétail à l’E.N.V.A.
Assesseur : M BOULOUIS
Professeur de pathologie générale, microbiologie, immunologie à l’E.N.V.A.

SOMMAIRE
INTRODUCTION
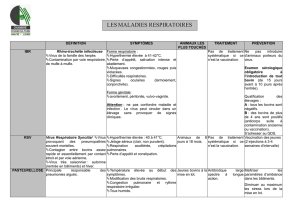
1. GENERALITES CONCERNANT LE V.R.S.
1.1 VIROLOGIE
1.2 EPIDEMIOLOGIE
1.2.1 Distribution
1.2.2 Prévalence
1.2.3 Source virale
1.2.4 Transmission
1.2.5 Réceptivité
1.3 PATHOGENIE
1.4 ETUDE CLINIQUE
1.4.1. Symptômes
1.4.2 Tableau lésionnel
1.4.2.1 Examen nécropsique
1.4.2.2 Examen histologique
1.4.3 Diagnostic
1.4.3.1 Diagnostic clinique
1.4.3.2 Diagnostic nécropsique et histologique
1.4.3.3 Diagnostic virologique
1.4.3.4 Mise en évidence de l’antigène viral
1.4.3.5 Immuno-histo-chimie
1.4.3.6 Détection des acides nucléiques d’origine
virale
1.4.3.7 Diagnostic indirect : l’examen sérologique
1.4.3.8 Conclusion
P 5
P7
P7
P8
P8
P9
P9
P11
P12
P13
P16
P16
P17
P17
P19
P21
P21
P21
P22
P22
P23
P23
P25
P27
1

1.5 TRAITEMENT ET PROPHYLAXIE
1.5.1 Traitement
1.5.2 Prophylaxie
1.5.2.1 Prophylaxie sanitaire
1.5.2.2 Prophylaxie médicale
CONCLUSION
2. LE VIRUS RESPIRATOIRE SYNCYTIAL CHEZ LA VACHE
LAITIERE
2.1 ETUDE EPIDEMIOLOGIQUE HORIZONTALE EN ELEVAGE
LAITIER
2.1.1 Matériels et méthodes
2.1.1.1 Elevages sélectionnés
2.1.1.2 Conduites d'élevages
2.1.1.3 Signes cliniques de maladies respiratoires
2.1.1.4 Prélèvements et examens
2.1.1.5 Interprétation des résultats sérologiques
2.1.1.6 Les sentinelles
2.1.2 Résultats de l'enquête
2.1.2.1 Primo-infections et réinfections
2.1.2.2 Résultat du dosage des IgM
2.1.2.3 Recherche des IgA dans les sécrétions
nasales
2.1.2.4 Infections sur les sentinelles
2.1.2.5 Observation des signes cliniques
2.1.3 Interprétation
2.2 PATHOLOGIES RESPIRATOIRES LIEES AU R.S.V.
CHEZ LES VACHES LAITIERES
2.2.1 De la suspicion clinique au diagnostic
2.2.2 Isolement du V.R.S. sur des bovins laitiers adultes
2.3 OBSERVATIONS CLINIQUES PERSONNELLES
P28
P28
P29
P29
P30
P31
P33
P33
P34
P34
P34
P36
P36
P37
P37
P38
P38
P38
P40
P40
P40
P41
P44
P44
P47
2

2.3.1 Elevage A
2.3.1.1 Caractéristiques de l'exploitation
2.3.1.2 Description de l'épizootie
2.3.1.3 Symptômes observés
2.3.1.4 Examens réalisés et résultats
2.3.1.5 Intreprétation et conclusion
2.3.2 Elevage B
2.3.2.1 Caractéristiques de l'exploitation
2.3.2.2 Description de l'épizootie
2.3.2.3 Symptômes observés
2.3.2.4 Examens réalisés et résultats
2.3.2.5 Interprétation et conclusion
2.3.3 Elevage C
2.3.3.1 Caractéristiques de l'élevage
2.3.3.2 Description de l'épizootie
2.3.3.3 Symptômes observés
2.3.3.4 Examens réalisés et résultats
2.3.3.5 Interprétation et conclusion
2.3.4 Elevage D
2.3.4.1 Caractéristiques de l'élevage
2.3.4.2 Description de l'épizootie
2.3.4.3 Symptômes observés
2.3.4.4 Examens réalisés et résultats
2.3.4.5 Interprétation et conclusion
2.3.5 Elevage E
2.3.5.1 Caractéristiques de l'élevage
2.3.5.2 Description de l'épizootie
2.3.5.3 Description des symptômes
2.3.5.4 Analyses effectuées
2.3.5.5 Interprétation et conclusion
2.3.6 Elevage F
2.3.6.1 Caractéristiques de l'exploitation
2.3.6.2 Description de l'épizootie
2.3.6.3 Symptômes observés
2.3.6.4 Examens réalisés et résultats
2.3.6.5 Interprétation et conclusion
P52
P53
P53
P54
P54
P55
P57
P59
P59
P59
P60
P60
P60
P61
P61
P62
P63
P63
P65
P67
P67
P68
P68
P69
P71
P71
P71
P72
P73
P73
P76
P76
P76
P77
P78
P78
P79
3

2.3.7 Elevage G
2.3.7.1 Caractéristiques de l'exploitation
2.3.7.2 Description de l'épizootie
2.3.7.3 Symptômes observés
2.3.7.4 Examens réalisés
2.3.7.5 Résultats
2.3.7.6 Interprétation
CONCLUSION
CONCLUSION GENERALE
P81
P81
P81
P82
P82
P83
P85
P85
P87
4
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
1
/
97
100%