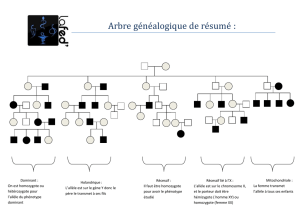
Polymorphismes des glutathion S-transférases et pathologies

Polymorphismes des glutathion S-transférases
et pathologies humaines :
bilan des études épidémiologiques
M. Habdous
G. Siest
B. Herbeth
M. Vincent-Viry
S. Visvikis
Inserm U 525, Centre de médecine
préventive, 2, avenue du Doyen Jacques
Parisot, 54501 Vandœuvre-Lès-Nancy
Article reçu le 17 mars 2003,
accepté le 26 juin 2003
Résumé. Les glutathion S-transférases (GST), enzymes polymorphes, méta-
bolisent des xénobiotiques impliqués dans la survenue de pathologies comme
les cancers, les maladies cardiovasculaires et respiratoires. Les variants alléli-
ques des classes GSTM1, T1 et P1 pourraient moduler la susceptibilité indivi-
duelle à ces pathologies. Les méta-analyses montrent que l’allèle nul
GSTM1*0 est associé à une faible augmentation des cancers du poumon (OR
(95 % IC) = 1,17 (1,07-1,27)), de la vessie (OR = 1,44 (1,23-1,68) et du larynx
(OR = 1,42 (1,10-1,84)). Seul l’allèle nul GSTT1*0 semble être associé à une
augmentation du risque de tumeurs du cerveau (astrocytomes (OR = 2,36 (1,41-
3,94) et méningiomes (OR = 3,57 (1,82-6,92)). Certains variants alléliques de
la GSTP1 sont associés à une augmentation de risque de cancer de la vessie
chez les fumeurs (OR = 2,40 (1,12-4,95)) et de l’asthme (OR = 3,5 (2,7-4,6)).
Enfin, le risque coronarien est augmenté chez les fumeurs porteurs de l’allèle
nul GSTM1*0 (OR = 2,30 (1,40-9,00)) et de l’allèle fonctionnel GSTT1*1
(OR = 2,5 (1,30-4,80)). Ce dernier est également associé à une augmentation
du risque d’artériopathie des membres inférieurs (OR = 3,60 (1,40-9,00)). Ces
données montrent que les polymorphismes des GST sont des facteurs de risque
pour ces pathologies. Contrairement aux maladies cardiovasculaires, ces fac-
teurs de risque paraissent indépendants de la consommation de tabac dans le
cas du cancer du poumon alors qu’ils n’ont pas été examinés dans les autres
cancers. Par conséquent, d’autres travaux sont nécessaires pour étudier les
interactions potentielles entre les génotypes GST et des carcinogènes chimi-
ques, notamment ceux présents dans la fumée de tabac.
Mots clés : glutathion S-transférase, cancer, maladie cardiovasculaire,
épidémiologie
Summary. Glutathione S-transferases (GST), xenobiotic-metabolising enzy-
mes, are involved in the metabolic detoxification of various environmental
carcinogens. Particular genetic polymorphisms of these enzymes have been
shown to influence individual susceptibility against various pathologies inclu-
ding cancer, cardiovascular and respiratory diseases. The results from the meta-
analysis indicate that GSTM1*0 null allele was associated with enhanced risk
for lung (OR (95% IC) = 1,17 (1,07-1,27)), bladder (OR = 1,44 (1,23-1,68)
and larynx cancer (OR = 1,42 (1,10-1,84)). GSTT1 null genotype was associa-
ted with increased astrocytomas (OR = 2,36 (1,41-3,94)) and meningiomas
(OR = 3,57 (1,82-6,92)) cancer risk. GSTP1 allelic polymorphism influence
the development of bladder cancer in smokers (OR = 2,40 (1,12-4,95)) and
occupational asthma (OR = 3,5 (2,7-4,6)). Finally, GSTM1*0 null allele and
GSTT1*1 functional allele were associated with increased risk for coronary
heart diseases in smokers (OR = 2,30 (1,40-9,00)) and OR = 2,5 (1,30-4,80),
respectively). The GSTT1*1 functional allele was also significantly associated
with increased risk of lower extremity arterial disease (OR = 3,60 (1,40-9,00).
These epidemiological data suggest that genetic GST polymorphisms influence
revue générale abc
Ann Biol Clin 2004, 62 : 15-24
Ann Biol Clin, vol. 62, n° 1, janvier-février 2004 15
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

the individual susceptibility to these diseases. Contrary to cardiovascular di-
sease, no evidence of interaction between GST genotype and smoking status
was found in lung cancer but it has not been studied in other cancers. Conse-
quently, other works are necessary to study the potential interaction between
GST genotype and environmental carcinogens including tobacco smoke ex-
tract.
Key words: glutathione S-transferase, cancer, cardiovascular disease,
epidemiology
L’organisme vivant est constamment exposé aux compo-
sés exogènes carcinogènes tels que la dioxine, les nitroso-
amines et les hydrocarbures aromatiques polycycliques.
Pour neutraliser leurs effets toxiques, l’organisme possède
un système multi-enzymatique complexe permettant l’éli-
mination de ces substances hydrophobes par les urines ou
la bile. Le foie est, de loin, l’organe le plus impliqué dans
ces biotransformations mais d’autres organes ou tissus
comme l’intestin, le rein, le poumon et la peau contribuent
également de façon importante au métabolisme et à l’éli-
mination de ces composés. Le métabolisme des xénobioti-
ques est orchestré en trois phases : I (réactions d’oxyda-
tion), II (réactions de conjugaison) et III (systèmes de
transport impliquant les protéines ABC) (tableau I). Toute
variation dans l’activité de ces enzymes pourra potentiel-
lement avoir des répercussions significatives sur le devenir
des composés médicamenteux et carcinogènes et sur les
quantités des métabolites produits. Actuellement, il est
clairement établi que les polymorphismes génétiques des
enzymes du métabolisme des médicaments (EMX) in-
fluencent la susceptibilité individuelle vis-à-vis de certai-
nes pathologies comme les cancers, les maladies cardio-
vasculaires et inflammatoires. Parmi ces enzymes, les
glutathion S-transférases (GST), enzymes polymorphes
impliquées dans la conjugaison du glutathion réduit à des
composés électrophiles nocifs et dans la chimiorésistance
aux agents anticancéreux, occupent une place très impor-
tante dans le système de défense cellulaire. Comme les
GST détoxiquent les composés carcinogènes, plusieurs
études épidémiologiques ont examiné l’incidence de leurs
polymorphismes génétiques sur le risque de survenue et/ou
l’aggravation de nombreuses pathologies comme les can-
cers et les maladies cardiovasculaires. Nous allons présen-
ter et discuter ces données après un bref rappel des traits
importants relatifs à ces enzymes.
Les glutathion S-transférases
Généralités
Les glutathion S-transférases cytosoliques (GST, E.C
2.5.1.18) représentent une importante familles d’isoenzy-
mes polymorphes réparties en huit classes : mu (GSTM),
alpha (GSTA), pi (GSTP), thêta (GSTT), zêta (GSTZ),
sigma (GSTS), kappa (GSTK) et omega (GSTO) [1-3].
Les GST sont des enzymes solubles avec une masse molé-
culaire d’environ 25 kDa, dimériques et largement répan-
dues dans la faune et la flore. Chaque sous-unité GST
porte deux sites de fixation : le premier est spécifique du
glutathion réduit (GSH), site « G », alors que le second
l’est pour le substrat proprement dit, site « H ». De plus,
certaines GST (au moins les GSTA et P) possèdent un
troisième site non spécifique qui serait soit impliqué dans
le transport des molécules hydrophobes comme la biliru-
bine, soit serait comme un site régulateur qui supprimerait
parfois l’activité de l’enzyme allostérique [4]. La localisa-
tion chromosomique, tissulaire et les caractéristiques
physico-chimiques des GST sont indiquées dans les ta-
bleaux II et III. Si leur structure est généralement simi-
laire, leur point isoélectrique est en revanche différent et
permet de les classer en trois groupes : basique (GSTA),
neutre (GSTM) et acide (GSTT et GSTP) [1, 2].
Les fonctions biologiques remplies par les GST sont diver-
ses. Les plus importantes sont la détoxication des xéno-
biotiques, le transport, le métabolisme des éicosanoïdes et
l’activation de certains substrats (figure 1). En effet, les
GST catalysent la conjugaison du GSH à différents subs-
trats électrophiles, issus de la phase I, nocifs pour la cel-
Tirés à part : G. Siest
Abréviations
ABC : ATP-binding cassette
GST : glutathion S-transférases
HAP : hydrocarbures aromatiques polycycliques
MDR : multidrug resistance
MOAT : multispecific organic anion transport
MRP : multidrug resistance-associated protein
OR : odds ratio
VADS : voies aéro-digestives supérieures
revue générale
Ann Biol Clin, vol. 62, n° 1, janvier-février 200416
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Tableau II. Nomenclature, localisation chromosomique et caractéristiques physico-chimiques des GST humaines les plus étudiées
[1-3, 5, 6].
Classes Enzymes Autres nomenclatures AA PM PI Gènes Localisation
chromosomique
Alpha
hGSTA1 hGSTA1-1 GST2-type 1 ou GSTe222 26,9 8,9 hGSTA1 6p12.1
hGSTA2 hGSTA2-2 GST2-type 2 ou GSTγ222 26,9 8,4 hGSTA2 6p12.1
hGSTA3 hGSTA3-3 nd nd nd hGSTA3 6p12.1
hGSTA4 hGSTA4-4 222 25,7 5,8 hGSTA4 6p12.1
hGSTA5 hGSTA5-5 nd nd nd hGSTA5 6p12.1
Mu
hGSTM1 hGSTM1a-1a GST1-type 2 ou GSTµ 218 26,7 6,1 hGSTM1 1p13.3
hGSTM1b-1b GST1-type 1 ou GST ψ218 26,6 5,5 hGSTM1 1p13.3
hGSTM1a-1b GSTµ/ ψ218 26,6 5,8 hGSTM1 1p13.3
hGSTM2 hGSTM2-2 GST4 218 26,3 5,4 hGSTM2 1p13.3
hGSTM3 hGSTM3-3 GST5 225 26,5 5,2 hGSTM3 1p13.3
hGSTM4 hGSTM4-4 218 26,4 5,2 hGSTM4 1p13.3
hGSTM5 hGSTM5-5 218 26,0 nd hGSTM5 1p13.3
Pi
hGSTP1 hGSTP1-1 GST3 ou GSTπ210 23,0 4,8 hGSTP1 11q13.3
Thêta
hGSTT1 hGSTT1-1 GST θ240 26,7 4,6 hGSTT1 22q11.2
hGSTT2 hGSTT2-2 GSTT2 244 25,1 nd hGSTT2 22q11.2
AA = nombre d’acide aminé par sous-unité ; MM : masse moléculaire d’une sous-unité exprimée en kilodalton (kDa) ; PI : point isoélectrique ; nd = non
déterminé.
Tableau I. Exemples de réactions de transformation des médicaments et des substances étrangères au sein de l’organisme.
Réactions Enzymes Substrats connus
Phase I
Oxydation Hydroxylation, oxydation Cytochromes P450 Phénobarbital, aniline, phénothiazine, HAP
Décarboxylation, désamination Cytochromes P450 Codéine, amphétamine, histamine
Déshydrogénation Alcool déshydrogénase Alcool
Déshydrogénation des amines Monoamine oxydase Catécholamine
Déhalogénation Cytochromes P450 Hydrocarbures dihalogénés
Oxydation des radicaux Superoxyde dismutase Oxygène singulet, radical hydroxyle
Réduction Peroxydation Glutathion peroxydase Lipoperoxydes
NAD(P)H-quinone oxydoréductase Quinones
Phase II
Conjugaison Glucuronoconjugaison UDP-glucuronosyltransférases Phénol, alcool, amines, sulfamide, morphine
Sulfoconjugaison Sulfotransférases Phénol, amines aromatiques, sulfamides
Acétylation O-, N-acétyltransférases Sulfamides, procaïne
Méthylation O-, N-méthyltransférases Nicotinamides
Conjugaison au GSH Glutathion-S-transférases Époxydes, lipoperoxydes, quinones, carbonyles α,-insaturés,
anticancéreux
Phase III
Protéines ABC
MRP Transport Médicaments, conjugués au GSH et à l’acide glucuronique
MDR Transport Médicaments, conjugués au GSH et à l’acide glucuronique
MOAT Transport Médicaments, conjugués au GSH et à l’acide glucuronique
Glutathion S-transférases
Ann Biol Clin, vol. 62, n° 1, janvier-février 2004 17
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

lule. Par conséquent, elles constituent une importante li-
gne de défense protégeant les composants cellulaires
(ADN, lipides et protéines) des effets délétères induits par
ces composés. La réaction de conjugaison aboutit à la
formation de l’acide mercapturique qui sera ensuite ex-
crété via la bile ou le rein [1]. Les GST jouent aussi un
rôle important dans le transport de composés endogènes
(les hormones, les stéroïdes, l’acide urique et la bilirubine)
et dans le métabolisme des éicosanoïdes (synthèse des
prostaglandines E
2
,F
2a
,D
2
et des leucotriènes C
4
,E
4
) [1,
2]. Récemment, plusieurs études suggèrent que les GST
jouent aussi un rôle antioxydant important protégeant les
cellules des dommages occasionnés par les radicaux libres
et leurs adduits (hydroxylipoperoxydes, quinones et les
carbonyles a,b-insaturés) [3]. Bien que la grande majorité
des xénobiotiques soit neutralisée par les GST, il existe
plusieurs cas pour lesquels la catalyse impliquant ces enzy-
mes ne conduit pas à une détoxication complète [4]. Ainsi,
certains conjugués GS néoformés sont instables et peuvent
être clivés donnant des métabolites souvent très toxiques.
Ce processus de thiolyse rend la détoxication du conjugé
GS incomplète et expose la cellule à la menace chimique
du métabolite. Ainsi, la conjugaison GST-dépendante sem-
ble être réversible permettant sous certaines conditions la
régénération du composé « parental » cytotoxique. Ce cas
de figure est rencontré lors de la catalyse GST-dépendante
des isothiocyanates [4]. La réversibilité de la réaction de
conjugaison signifie que les conjugués GS constituent des
formes temporaires de stockage et de transport plutôt
qu’une détoxication proprement dite. Dans le cas des hy-
drocarbures mono- ou di-halogénés tels que le dibromo-
méthane et le dichlorométhane, la conjugaison GST-
dépendante conduit directement à l’activation du substrat
impliquant surtout l’isoenzyme GSTT1. Cette conjugai-
son conduit à l’activation du substrat via la formation d’un
composé électrophile très réactif, l’ion épisulfonium. Ce
dernier est hautement mutagène et est responsable de la
néphrotoxicité et de la carcinogenèse de ces composés [1,
4]. Enfin, l’activation du métabolite néoformé fait interve-
nir une autre enzyme comme la b-lyase [4]. C’est le cas de
l’hexachlorobutadiène et le tétrachloroéthane qui sont
transportés du foie vers le rein après leur inactivation via
le système GST/GSH. Dans le rein, le conjugué GS subit
des modifications en vue de sa transformation en acide
mercapturique grâce à l’action concertée de trois enzy-
mes : la c-glutamyltransférase, la dipeptidase et la b-lyase.
Le conjugué GS perd ainsi deux acides aminés (le gluta-
mate et la glycine) mais dans certains cas il donne un
métabolite (cystéine-S-X) néphrotoxique [4].
Polymorphismes génétiques des GST
Cinq classes de GST exhibent des polymorphismes géné-
tiques : GSTA, GSTM, GSTP, GSTT et GSTZ. Les poly-
morphismes les plus étudiés et documentés sont ceux rela-
tifs aux sous-classes GSTM1, T1 et P1 (tableau IV).
Pour la sous-classe GSTM1, la variation nucléotidique
(G2619C) et une délétion complète du gène gstm1 sont
responsables de la présence de trois allèles nommés :
GSTM1*A,GSTM1*B et GSTM1*0. Les deux premiers
diffèrent par une seule base au niveau de l’exon 7 qui ne
semble pas affecter l’activité de l’enzyme. En revanche, la
présence de l’allèle nul GSTM1*0 se traduit par l’absence
Tableau III. Localisation tissulaire des GST les plus étudiées [1, 2, 5, 6].
Enzymes GST Alpha Mu Pi Thêta
A1/2 M1-1 M2-2 M3-3 M4-4 M5-5 P1-1 T1-1 T2-2
Érythrocyte –––– ±+
Cerveau ± + + + + + + + + –
Vessie + + + +
Peau + + ± – – + + –
Cœur ± + (+) (+) (+) (+) + + –
Testicule + + + + + + + + + +
Foie + + + (+) (±) + – (+) + +
Poumon + + (+) (+) (+) + + + –
Lymphocytes +
Estomac/intestin + ± +
Muscle – + + + – + – + + –
Rein + + (+) – + – + –
Ovaire + + +
Pancréas + (+) + – +
Placenta ––––+–++–
Prostate + ++
Utérus + + +
+ + : expression forte ; + : expression moyenne ; (+) : expression faible ; – : pas d’expression.
revue générale
Ann Biol Clin, vol. 62, n° 1, janvier-février 200418
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

de l’enzyme GSTM1. Les sujets porteurs de la délétion du
gène gstm1 semblent incapables de métaboliser des époxy-
des ou des quinones [1, 2]. Chez les Caucasiens, la fré-
quence de l’allèle nul GSTM1*0 est de 50 % et de 27 %
dans la population asiatique.
Plusieurs études ont confirmé la présence du phénotype
nul GSTT1 suite à la délétion du gène gstt1 [1]. Récem-
ment, une variation nucléotidique a été trouvée au niveau
du gène gstt1 (A310C) qui transforme le résidu thréonine
104 en proline [5]. Ainsi, trois allèles sont décrits pour
cette classe : GSTT1*A,GSTT1*B et GSTT1*0. Ces
auteurs confirment la distribution trimodale de l’activité
GST décrite par d’autres études. En effet, en fonction du
génotype GSTT1, les sujets sont classés en trois catégo-
ries : métaboliseurs nuls, lents et rapides. La fréquence de
l’allèle nul GSTT1*0 est de 20 % dans la population cau-
casienne et de 61 % dans la population asiatique. La
GSTP1 présente quatre variants alléliques nommés
GSTP1*A,GSTP1*B, GSTP1*C et GSTP1*D [6]. Ces
variants résultent de la présence de deux variations nucléo-
tidiques au niveau de la séquence codante (A313G et
C341T). Ces transitions nucléotidiques transforment le co-
don ATC (isoleucine) en position 105 dans les GSTP1*A
et 1*D en GTC (valine) dans les GSTP1*B et 1*C. Quant
au codon GCG (alanine) en position 114, initialement pré-
sent dans les GSTP1*A et 1*B, il est transformé en GTG
(valine) dans les GSTP1*C et 1*D. Ces changements ont
une incidence sur la structure tridimensionnelle de l’en-
zyme et sur la stéréospécificité du site catalytique [7].
In vitro, l’activité enzymatique de la GSTP1 est quatre
fois plus faible pour les variants alléliques GSTP1*B et
GSTP1*C comparés à l’allèle de référence GSTP1*A
[6, 7].
Cancer et GST
De plus en plus de preuves indiquent que les sujets fu-
meurs ne sont pas tous égaux devant le cancer. À consom-
mation égale, certains sujets développeront des cancers et
d’autres n’en seront jamais atteints. La susceptibilité indi-
viduelle aux cancers induits par des carcinogènes chimi-
ques pourrait être en partie expliquée par des différences
génétiques dans la détoxication et/ou l’activation des pro-
carcinogènes. Ainsi, de nombreuses études épidémiologi-
ques se sont intéressées à l’incidence des polymorphismes
GST sur le risque de développement de cancers liés au
tabac tels que celui du poumon, des voies aéro-digestives
supérieures (VADS) ou de la vessie. Ce risque a été appré-
cié par l’odds ratio (OR) dans le cas d’une seule étude
cas/témoin ou un méta-OR pour des méta-analyses. Les
tableaux V et VI résument les principaux résultats des
études épidémiologiques relatives à l’incidence des poly-
morphismes de la GSTM1 et GSTT1 sur le risque de
survenue de ces pathologies.
Cancer du poumon
Une récente méta-analyse [8] a conclu à une faible aug-
mentation du risque de cancer du poumon chez les sujets
ayant l’allèle nul GSTM1*0 [43 études, méta-OR = 1,17
(1,07-1,27)] (tableau V). Ce risque est différent selon l’ori-
gine ethnique des patients. Ainsi, chez les Caucasiens, le
risque de cancer de poumon associé à l’absence de la
GSTM1 est faible [20 études, méta-OR = 1,10 (1,01-1,19)
comparé aux Asiatiques [12, méta-OR = 1,33 (1,06-1,67)]
et aux Latino-Américains [1 étude, OR = 1,88 (1,00-
3,29)]. La consommation de tabac est un important facteur
de risque de cancer du poumon. Comparé aux non fu-
meurs, le risque de cancer du poumon est respectivement
de 5, 22 et 35 fois plus élevé chez les fumeurs avec une
consommation inférieure à 20 paquets-années [OR = 5,50
(4,17-7,26)], chez les fumeurs moyens (20-39 paquets-
Tableau IV. Principaux polymorphismes caractérisés pour les
classes GST les plus étudiées [2, 5, 6, 8, 10, 11].
Classe GST Gène Variants
alléliques
Conséquence
Mu hGSTM1 hGSTM1*A Lys173
hGSTM1*B Lys173Asn
hGSTM1*0 Absence de l’enzyme
Pi hGSTP1 hGSTP1*A Ile105/Ala114
hGSTP1*B Ile105Val/Ala114
hGSTP1*C Ile105Val/Ala114Val
hGSTP1*D Ile105/Ala114Val
Thêta hGSTT1 hGSTT1*A Wt
hGSTT1*B Thr104Pro
hGSTT1*0 Absence de l’enzyme
Wt, type sauvage.
Activation des métabolites
Détoxication
Phase I
GST/GSH
Voie conjugative
Protéines
ADN
Excrétion
Régulation
métabolique
Inflammation
Oxygène
moléculaire
Endobiotes Xénobiotiques
Exemple : tabac, médicaments,
carcinogènes chimiques, etc.
Exemple : éicosanoïdes,
stéroïdes, quinone, etc.
Phase II
Phase III
Carcinogenèse
Pathologies
Réactions de fonctionnalisation
(cytochromes P-450)
Effets géno/cytotoxiques
Figure 1. Métabolisme des xénobiotiques et endobiotes par les
enzymes du métabolisme des médicaments et leurs conséquen-
ces.
Glutathion S-transférases
Ann Biol Clin, vol. 62, n° 1, janvier-février 2004 19
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%