Télécharger - Bienvenue sur le site des Thèses d`exercice

!
!
"!
"#$%&'($)&!)*"+*"(&!$$$,!-."+!(./.)$&'!!
0.1"+)&!2&!13$'"'4$&!2&#).$'&!
!
#$$%&!"'("!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!"'(")*+,-)-'./!
!
)3&(&!
5678!9:!
2$-+*;&!2<&).)!2&!2*1)&"'!&#!13$'"'4$&!2&#).$'&!
-8=>:?@=:!:@!>67@:?7:!57A9BC7:D:?@!
5E8!
1=FB9:!-.'&2&(!
9:!GH!?6I:DA8:!GJKG!
!
2&#)$#*4&#&(&!$;-.'0.$)&!!
!
2&!)L-&!$$!
!
-'&(&#).)$*#!2<"#!1.(!0.;$+$.+!
!
2B8:F@:78!M:!@NO>:!P!28!Q79B:!/.1R"&!
!
Q"'L!
01%234&$5!6!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!7289&::&!;#7<<=,<!>+?=@*7=?!
(&1!#22&22&A1!6!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!BA:3&!;#CD,=!
"EF&!#22&22&A1!6!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!?%F3!=@C<#@@#G!
-EF&!#22&22&A1!6!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!>1%4%13H!I#J@@=!
!
!
!

!
!
-!
FACULTÉ DE CHIRURGIE DENTAIRE
!
DIRECTION
DOYEN
Mr SIXOU Michel
ASSESSEURS DU DOYEN
•
ENSEIGNANTS :
Mme GRÉGOIRE Geneviève
Mr CHAMPION Jean
Mr HAMEL Olivier
Mr POMAR Philippe
•
PRÉSIDENTE DU COMITÉ SCIENTIFIQUE
Mme GRIMOUD Anne-Marie
•
ÉTUDIANT :
Mr HAURET-CLOS Mathieu
CHARGÉS DE MISSION
Mr PALOUDIER Gérard
Mr AUTHER Alain
RESPONSABLE ADMINISTRATIF
Mme GRAPELOUP Claude
!
HONORARIAT
DOYENS HONORAIRES
Mr LAGARRIGUE Jean !
Mr LODTER Jean-Philippe
Mr PALOUDIER Gérard
Mr SOULET Henri
!
ÉMÉRITAT
Mr PALOUDIER Gérard
!
PERSONNEL ENSEIGNANT
56.01 PÉDODONTIE
Chef de la sous-section : Mr VAYSSE
Professeur d'Université : Mme BAILLEUL-FORESTIER
Maîtres de Conférences : Mme NOIRRIT-ESCLASSAN, Mr VAYSSE
Assistants : Mlle BACQUÉ, Mr DOMINÉ
Chargé d’Enseignement : Mlle BACQUÉ, Mme PRINCE-AGBODJAN, Mr TOULOUSE
56.02 ORTHOPÉDIE DENTO-FACIALE
Chef de la sous-section : Mr BARON
Maîtres de Conférences : Mr BARON, Mme LODTER, Mme MARCHAL-SIXOU, Mr ROTENBERG,
Assistants : Mme ELICEGUI, Mme OBACH-DEJEAN, Mr PUJOL
Chargés d'Enseignement : Mr GARNAULT, Mme MECHRAOUI, Mr MIQUEL
56.03 PRÉVENTION, ÉPIDÉMIOLOGIE, ÉCONOMIE DE LA SANTÉ, ODONTOLOGIE LÉGALE
Chef de la sous-section : Mr HAMEL
Professeur d'Université : Mme NABET, Mr PALOUDIER, Mr SIXOU
Maître de Conférences : Mr HAMEL
Assistant : Mr MONSARRAT
Chargés d'Enseignement : Mr DURAND, Mr PARAYRE, Mr VERGNES
57.01 PARODONTOLOGIE
Chef de la sous-section : Mr BARTHET
Maîtres de Conférences : Mr BARTHET
Assistants : Mr MOURGUES, M
Chargés d'Enseignement : Mr. CALVO, Mme DALICIEUX-LAURENCIN, Mr LAFFORGUE, Mr PIOTROWSKI,
Mr SANCIER

!
!
K!
57.02 CHIRURGIE BUCCALE, PATHOLOGIE ET THÉRAPEUTIQUE, ANESTHÉSIOLOGIE
ET RÉANIMATION
Chef de la sous-section : Mr CAMPAN
Professeur d'Université : Mr DURAN
Maîtres de Conférences : Mr CAMPAN, Mr COURTOIS, Mme COUSTY
Assistants : Mme BOULANGER, Mr FAUXPOINT, Mme FERNET-MAGNAVAL
Chargés d'Enseignement : Mr GANTE, Mr L’HOMME, Mme LABADIE, Mr PLANCHAND, Mr SALEFRANQUE
57.03 SCIENCES BIOLOGIQUES (BIOCHIMIE, IMMUNOLOGIE, HISTOLOGIE, EMBRYOLOGIE.
GÉNÉTIQUE, ANATOMIE PATHOLOGIQUE, BACTÉRIOLOGIE, PHARMACOLOGIE
Chef de la sous-section : Mr KÉMOUN
Professeurs d'Université : Mme DUFFAUT
Maîtres de Conférences : Mme GRIMOUD, Mr KEMOUN, Mr POULET
Assistants : Mr BLASCO-BAQUE, Mme GAROBY-SALOM, Mme SOUBIELLE, Mme VALERA
Chargés d'Enseignement : Mr BARRÉ, Mme DJOUADI-ARAMA, Mr SIGNAT
58.01 ODONTOLOGIE CONSERVATRICE, ENDODONTIE
Chef de la sous-section : Mr GUIGNES
Maîtres de Conférences : Mr DIEMER, Mr GUIGNES, Mme GURGEL-GEORGELIN, Mme MARET-COMTESSE
Assistants : Mr ARCAUTE, Mlle DARDÉ, Mme DEDIEU, Mr ELBEZE, Mme FOURQUET, Mr
MICHETTI
Chargés d'Enseignement : Mr BALGUERIE, Mr BELAID, Mlle BORIES, Mr ELBEZE, Mr MALLET, Mlle PRATS,
Mlle VALLAEYS
58.02 PROTHÈSES (PROTHÈSE CONJOINTE, PROTHÈSE ADJOINTE PARTIELLE, PROTHÈSE
COMPLÈTE, PROTHÈSE MAXILLO-FACIALE)
Chef de la sous-section : Mr CHAMPION
Professeurs d'Université : Mr ARMAND, Mr POMAR
Maîtres de Conférences : Mr BLANDIN, Mr CHAMPION, Mr ESCLASSAN
Assistants : Mr DESTRUHAUT, Mr GALIBOURG, Mr LUCAS, Mr RAYNALDY, Mme SOULES
Chargés d'Enseignement : Mr ABGRALL, Mr DEILHES, Mr FARRÉ, Mr FLORENTIN, Mr FOLCH,
Mr GHRENASSIA,
Mr KAHIL, Mme LACOSTE-FERRE, Mme LASMOLLES, Mr LUCAS, Mr MIR,
Mr POGEANT, Mr RAYNALDY
58.03 SCIENCES ANATOMIQUES ET PHYSIOLOGIQUES, OCCLUSODONTIQUES, BIOMATÉRIAUX,
BIOPHYSIQUE, RADIOLOGIE
Chef de la sous-section : Mme GRÉGOIRE
Professeur d'Université : Mme GRÉGOIRE
Maîtres de Conférences : Mme JONIOT, Mr NASR
Assistants : Mr AHMED, Mr CANIVET, Mr DELANNÉE
Chargés d'Enseignement : Mme BAYLE-DELANNÉE, Mme MAGNE, Mr MOUNET, Mr TREIL, Mr VERGÉ
----------
!
!L'université Paul Sabatier déclare n'être pas responsable des opinions émises par les candidats.
(Délibération en date du 12 Mai 1891).
Mise à jour au 23 octobre 2012

!
!
.!
.!D:>!SB9>T!+=6!:@!-E79L!!"#$%"&'&#$&()#*(#+$
!
,'#"($-.$-/0"$1.$0"$!"$2.'&$%.#$%"/(3$!4!"$5$-6/#/("$
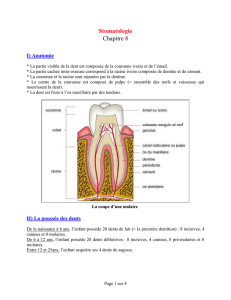
768$9(*'#$"09*("$"&$"0$9:/(;
!
<*&("$9=.0#*0$%"0>.0&$9"&&"$?@$*A$'-$2/&$#'$>'22'9'-"$>"$B*/#$-.'##"($
%*/($C$!"#$D.(>"#$5$-.$E+F+$G+$H"#$.!*/(#3$B*/#$.B"I$)&)$"&$("#&"I$!.$2*(9"$&*/&$./$-*0D$>"$9"#$
.00)"#+$J-*(#$B*/#$./##'$06.8"I$%.#$%"/(3$7"$#"(.'$&*/7*/(#$-5$%*/($B*/#$#*/&"0'(+$,*/#$4&"#$!"#$
%-/#$K"--"#$()/##'&"#$"&$#/'#$2'L("$>64&("$B*&("$!.!.0+$!
$
.! D:>! 5E8:?@>L! #.0#$ B*/#3$ ('"0$ >"$ &*/&$ 9"-.$ 06./(.'&$ )&)$ %*##'K-"$ "&$ 7"$ 06"0$ #"(.'$ %.#$ -5$
./7*/(>6=/'+$H"(9'$ >"$!6.B*'($ &*/7*/(#$#*/&"0/"3$ !"(9'$ %*/($B*&("$.!*/(3$ >"$ B*&("$9*02'.09"3$
B*#$9*0#"'-#$"&$&*/#$B*#$"09*/(.D"!"0&#$%(*>'D/)#$&*/&$./$-*0D$>"$9"#$.00)"#3$5$&*/#$9"#$"22*(&#$
"&$#.9('2'9"#$9*0#"0&'#+$
$
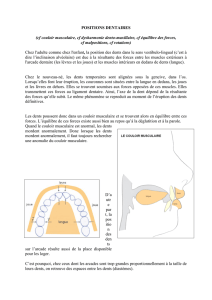
.! DE! >U78!#E@NE9B:L! &/$.#$&*/7*/(#$#/$M/"$76)&.'#$9.%.K-"$>"$-6'!%*##'K-"+$?.($&"#$C$2*(!/-"#$
!.D'M/"#$G$76.'$B.'09/$!"#$%"/(#$"&$!"#$>*/&"#+$H"(9'$%*/($&*/#$9"#$2*/#$('("#$"&$9"#$!*!"0&#$>"$
>)-'("3$!"(9'$>"$!"$2.'("$D(.0>'($'0&)('"/("!"0&$/0$%"/$%-/#$9=.M/"$7*/(+$N*!!"$O)*0.(>$5$#*0$
.(K("3$&/$!6.#$%(*>'D/)$&*/&"$&.$&"0>("##"3$&*0$.!*/(3$&*/&"#$9"#$.&&"0&'*0#$M/'$!6*0&$%"(!'#$>"$
#/'B("$!*0$9="!'0$#.0#$%"/($9.($7"$#.'#$M/"$&/$#"(.#$&*/7*/(#$-5$9*!!"$7"$-"$#"(.'$%*/($&*'+$$P"$
&6.'!"$!.$#:/("&&"M!
!
.!D6?!5:@B@!?:I:7!4VE9@>:?L!&"#$8"/Q$%)&'--"#$"&$7"$7/K'-";3$96"#&$/0$#'$D(.0>$K*0="/($>64&("$&.$
&.&'"$>"%/'#$R$!*'#+$H*0$%"&'&$9.(.!"-$&/$"#$5$9(*M/"($SSS!H"(9'$5$&*0$%.%.$T.(!.$"&$5$&.$!.!.0$
<.&=.-'"$%*/($.B*'($()/##'$/0"$&"--"$!"(B"'--";$
!
.!;E8F7>T!(@=5NE?B:T!'BFNE8M!:@!)N6DE>L!B*&("$.'>"$!"$2/&$#'$%()9'"/#";!!
!
.!D6?! 6?F9:!':?=!:@!DE! @E?@:!;EW@=L!!"(9'$%*/($&*/#$#"#$!*!"0&#$%.(&.D)#$;$U/)('D/&3$-"$
-*&*$>"#$K*0K*0#3$-"#$(.0>*#3$-"#$9L%"#$;0*/#$B*'-5;+$SS$
!
.!D:>!X8E?M>!5E8:?@>T!!"(9'$%*/($B*&("$.!*/(M!!
!
.! @67>! F:7Y! C7:! Z<EBD:L!!.$2.!'--"3$!"#$9*/#'0#3$>"$H*0&%"--'"(3$>"$<.(K*00"3$>"$?.('#$"&$>"$
V*/-*/#";H"(9'$%*/($&*/#$9"#$#*/B"0'(#$"0#"!K-"+$
!
.! 1V8B:99:L! !.$%"&'&"$N8983$!.$9=*/%'0"&&"3$0*/#$%.(&.D"*0#$&*/&$>"%/'#$ W$.0#;>"#$('("#3$>"#$
-.(!"#;0*#$ %"&'&#$ #"9("&#;+H"(9'$ >64&("$ &*/7*/(#$ -53$ >"$ !"$ #*/&"0'($ "&$ >"$ !6)9*/&"($ !4!"$ #'$
%.(2*'#$!"#$9=*'Q$#*0&$9*!%-'M/)#+$H"(9'$%*/($&*/#$9"#$K*0#$!*!"0$!.$N82'*0$>6.!*/(3$!.$
%"&'&"$%*/-"&&"$&/$#.'#$9*!!"$7"$&6.>*(";$
!
.!.X?O>T!1EDB99:T!16?>@E?F:T!&9DET!0E??VT!+B>:T!;E8B6?!;[T!;E8VT!#6=DB:T!-E79B?:T!0*/#$
0*/#$ B*8*0#$!*'0#$ M/6.B.0&3$ !.'#$ 7"$ %"0#"$ &*/7*/(#$ 2*(&$ 5$ B*/#$ !"#$ 9*%'0"#3$ B*/#$ !"$
!.0M/"I;$SSS$
$
.7Y!A6V>!C7:!Z:!?<EB!5E>!67A9B=T!!J-"Q.0>("3!E"(&(.0>3$X.K('I'*3$Y/'--./!"3$P.>3$Z"'I.3$[.!'$
!
.!'=DB!&[T!08E?F\!2[T!]B\BT!(BD6?T!(E8EN!1[T!-B5E567T!&DDE?7:99:!#,&T!Q:E?!1ML!!
28!.7@N:8T!!"(9'$%*/($B*&("$.'>"$"&$B*#$9*0#"'-#$#'$%()9'"/Q$"0$9-'0'M/"$$"&$&*/&$./$-*0D$>"$!*0$
9/(#/#+$
$
.!DE!5:@B@:!^!08EDA6B>:!»3$!"(9'$%*/($&*/&;Y.(>"I$B*&("$K*00"$=/!"/($"&$B*&("$%"%#+$
$
)6!'6AAB?L!8*/$\0*]$]=.&$8*/$!".0$&*$!"3$8*/6B"$.-].8#$K"-'"B">$'0$!";VO<^;++$
$
$
!
!

!
!
N!
A notre président de thèse
!
;EMED:!9:!-86S:>>:78!$>EA:99:!/.$++&"+,0*'&()$&'L!
, 01OP&22&A1!4&2!,$3Q&1235%2L!01853H3&$!RO2S358:3&1!4T+4O$5O:OU3&!
, VOH5&A1!&$!CW31A1U3&!V&$5831&L!
, V3S:XF&!4&!VOH5O185!4&!:T,$3Q&1235%!08132)V34&1O5L!
, <8A1%85&!4&!:T#H84%F3&!G853O$8:&!4&!CW31A1U3&!V&$5831&!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
GOA2! 8SS1%H3O$2! :TWO$$&A1!
YA&! QOA2! $OA2! P835&2! &$!
8HH&S58$5! 4&! S1%234&1! :&! ZA1[!
4&! $O51&! 5WE2&M! I&A3::&\!
51OAQ&1! 3H3! :T&]S1&223O$! 4&!
$O51&! S:A2! S1OPO$4! 1&2S&H5! &5!
4&!$O51&!23$HE1&!U18535A4&M!
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
1
/
112
100%