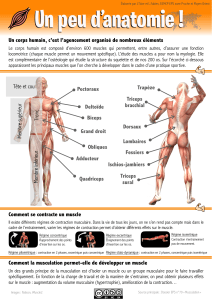
13 La figure précédente montre l`évolution de la puissance

13
La figure précédente montre l’évolution de la puissance spécifique en fonction de la
fréquence de contraction, pour une valeur donnée de contrainte et déformation (donc, pour
une quantité donnée de travail mécanique).
Les colibris ont une fréquence de battement de 30-50 Hz, ce qui est spectaculaire pour des
vertébrés. Des animaux volants plus petits, comme les mouches ou les abeilles, ont de
fréquences de battement d’ailes dans les centaines de Hz, et les moucherons produisent des
rumeurs audibles par les humains, de quelques kHz : si le travail mécanique spécifique était le
même pour tous ces animaux, la puissance devrait se rapprocher de la limite théorique
supérieure dans la figure. Ce qui n’est pas tout à fait le cas.
En effet, les estimations courantes sont basées sur des critères métaboliques, exprimés en
puissance par unité de poids, et non mécaniques, en puissance par unité de masse musculaire.
La conversion est compliquée, mais des indications générales nous disent que la puissance
dans les insectes ne dépasse pas les 200 W/kg, moins que ¼ de la limite indiquée dans la
figure pour des très hautes fréquences. La fréquence de battement augmente de plus en plus
que l’animal devient petit, mais par contre la puissance délivrée par unité de masse
musculaire atteint une valeur asymptotique. Donc, le travail mécanique (W=P/v) par cycle
doit diminuer en proportion avec la taille de l’animal.
Une possibilité de limiter le travail est qu’il existe une limite supérieure à
!
˙
"
, le taux de
déformation admissible, par exemple imposé par la fréquence maximale à laquelle les
molécules de myosine s’attachent aux actines.
Si l’on écrit le taux de déformation dans un démi-cycle de période
τ
= 1/
ν
comme :
[24]
!
˙
"
=
"
#
2=2
"$
Pour les grands animaux on considérait, plus haut, que la déformation
ε
était fixée. Par contre,
si l’on imagine qu’il soit plutôt le taux
!
˙
"
max
limité, la déformation
ε
doit progressivement
diminuer avec l’augmentation de la fréquence, comme :
[25]
!
"
=˙
"
max
2
#
ce qui est explicable, des muscles qui se contractent à des fréquences de plus en plus élevées
font une excursion plus courte. Il est énormément difficile de déterminer une valeur réaliste
de
!
˙
"
max
. Des estimations conservatives suggèrent qu’il pourrait prendre une valeur dans
l’intervalle 10-20 s-1 pour les insectes.
Si l’on prend donc 20 s-1 comme valeur limite du taux e déformation, l’eq.[25] nous donne la
règle pratique
ε
= 10/
ν
comme estimation de la limite de déformation cyclique. Une mouche
qui bat ses ailes à 250 Hz aurait le temps suffisant pour contracter ses muscles d’un
ε
=
10/250 = 0.4% à chaque cycle. Mais des insectes encore plus petits ne peuvent pas avoir assez
d’excursion musculaire pour bouger les ailes directement : ils doivent se ressortir à des
mécanismes de relais, les muscles provoquant une déformation du thorax, qui est transformée
en une plus ample excursion des ailes. Ceci est bien ce qu’on observe dans les insectes plus
évolués, qui utilisent des combinaisons complexes de paires antagonistes arrangées de

14
manière croisée, pour exploiter la traction ou compression additionnelle exercée par la
coquille rigide du thorax.
Les grillons qui sautent doivent réaliser des déformations extrêmes, dans des temps très
courts, même si non cycliques : d’autant plus qu’un animal est petit, d’autant plus court est le
temps (~1/v) disponible pour la déformation. Si l’extension était réalisée directement par les
muscles, le taux
!
˙
"
serait probablement au-delà de tout limite acceptable. Contrairement aux
croyances populaires, les pouces sont des très mauvais sauteurs. Ce qui devrait être vraiment
incroyable est bien qu’elles puissent du tout sauter !
6.8 - Muscles synchrones et asynchrones
Au cours de l’évolution, les animaux (et surtout les insectes) ont développé des stratégies
différentes pour satisfaire la nécessité de muscles qui puissent travailler à des fréquences de
contraction
ν
très élevées : a) une solution notamment quantitative, qui consiste à accélérer
toutes les phases du cycle de travail musculaire, de manière cohérente, ou plutôt, b) une
solution qualitative, dans laquelle quelques étapes (les plus longues) du cycle sont éliminées.
La solution quantitative est réalisée par les muscles synchrones, pour lesquels à chaque
impulsion excitatoire nerveuse correspond un cycle de contraction (c.-à-d., la fréquence des
excitations nerveuses est identique à la fréquence de contraction v). La solution qualitative
est, par contre, trouvée dans les muscles asynchrones, pour lesquels une seule impulsion
nerveuse donne origine à plusieurs (5 à 10, env.) contractions musculaires en séquence. Alors
que les vertébrés utilisent des muscles synchrones, dans presque tous les insectes on trouve
des muscles asynchrones.
Comme il est expliqué dans la figure suivante, l’impulsion électrique nerveuse qui commande
la contraction volontaire d’un muscle est transmise du nerf au muscle via un grand nombre de
jonctions : les « synapses neuro-musculaires ». Le potentiel électrique de la cellule neuronale
prend la forme d’un pic de voltage de quelques dizaines de mV, qui transporte l’information
jusqu’au muscle. A l’échelle microscopique, l’actionnement mécanique de la contraction (c.-
à-d. l’initiation de la contraction des sarcoméres, liée aux déplacements relatifs des filaments
d’actine et de myosine qui composent chaque sarcomére), est activé par un flux d’ions Ca2+.
Pourtant, comme il est dit dans la figure, le procès de diffusion des ions Ca2+, de la borne
terminale du nerf, à la borne du muscle, n’est pas du tout direct, mais il se fait par le biais des
nombreuses étapes élémentaires. En tout cas, on trouve que l’étape liée à la diffusion
membranaire des ions Ca2+ est la phase plus lente du procés (rate-limiting step).
Or, dès que le coefficient de diffusion D a des dimensions de [L2]/[T], ou bien le produit
[surface][fréquence], pour accélérer la diffusion à une fréquence donnée, il faut augmenter la
surface de contacte à travers laquelle les ions peuvent diffuser. Mais cela implique que la fibre
musculaire serait de plus en plus envahie par le reticulum sarcoplasmique, qui forme les
jonctions, ainsi laissant de moins en moins de volume disponible pour les myofibrilles. Donc,
une augmentation de la diffusion pour s’ajuster à des fréquences très élevées impliquerait
moins de fibres dans le volume, et donc une réduction de la puissance disponible. Cela n’est
pas, évidemment, la meilleure stratégie.
La solution adoptée par la sélection naturelle avec les muscles asynchrones est donc celle de
découpler la fréquence d’arrivée des impulsions nerveuses (et donc, le cycle de diffusion du

15
Ca2+), de la fréquence (bien plus élevée) de la contraction musculaire : à la place d’une seule,
chaque impulsion nerveuse provoque des nombreuses contractions musculaires.
Schéma de la jonction synaptique
neuromusculaire. La borne terminale de
la cellule neuronale, en blanc (dite borne
préjonctionnelle) contient beaucoup de
vésicules (synaptic vesicles). Chaque
vésicule est un paquet de
neurotransmetteur acétylcholine (ACh).
L'espace entre membrane pré et
postjonctionnelle (synaptic cleft) est de
l'ordre de 15-30 nm. L'arrivée d'une
impulsion électrique (potentiel d'action,
PA) dans le nerf ouvre les canaux de la
membrane qui laissent diffuser les ions
Ca2+, du coté du nerf. Le Calcium permet
aux vésicules de rentrer la membrane de
la cellule du muscle. Le contenu des
vésicules est ainsi libéré dans la cellule,
et le ACh va ouvrir les canaux Sodium de
la membrane musculaire. Cela provoque
le déclenchement d'un potentiel d'action
dans le muscle, qui ouvre à son tour les
canaux Ca2+ de la membrane du muscle.
Le Ca2+ diffuse dans le sarcomére
(indiqué sur le coté de la figure) et
permet la contraction musculaire.
L’étude reporté dans le TD suivant (« Power output by an asynchronous flight muscle from a
beetle », Journal of Experimental Biology, vol. 203, p. 2367 (2000)) est un des meilleurs
exemples d’étude de recherche sur des muscles d’insectes, pour mesurer la force produite par
les muscles actionneurs des ailes, le travail mécanique W résultant (en fait, l’intégral cyclique
de la force multipliée par la déformation du muscle durant le cycle), et la puissance P=Wv.
Les mesures ont été effectuées sur des muscles dissectés de l’animal mort, et placés dans un
système de micro dynamométres permettant d’imposer des charges constantes et de mesurer
le retour de force (donc la force exercée par le muscle), en fonction de la fréquence de la
stimulation mécanique (variation cyclique de
ε
), de la température (à traduire en la
température du corps de l’animal), et d’autres variables encore. La stimulation électrique
(provenant du nerf) était simulée par l’introduction dans le muscle de deux électrodes
d’argent (des fils de diamétre 100 µm) connectés à un générateur d’impulsions en forme de
sin(x). Aussi, des mesures réalisées sur des insectes vivants, battant les ailes mais
immobilisés, sont également reportées dans l’étude.

16
Fig. 1 : Contrainte en fonction du temps d’application du stimulus, pour une stimulation de type spasme
istantané (courbe bas) et une stimulation tétanique (courbe large). NOTE : une stimulation « tétanique » consiste
en l’application prolongée d’impulsions électriques à des fréquences de 100-200 Hz. Dans une telle condition, le
muscle n’a pas le temps de se relaxer, et l’effet des impulsions est superposé et amplifié, conduisant à une
contraction continue.
Fig. 2 : Contrainte isométrique (force/surface), durant un cycle d’extension/contraction sur des longueurs du
muscle L=x% de la longueur L0, pour la contraction tétanique et la contraction passive.

17
Fig. 3 - Variation de force du muscle au cours d’un cycle de élongation et relache. Courbes foncées : muscle
stimulé en tétanique (durée de la stimulation répresentée par la ligne foncée horizontale en A). Courbes minces :
muscle non stimulé (réponse libre, de type visco-élastique). En C, élongation en allée-retour (voir courbe
« strain », en bas du C), et réponse de force correspondante. En stimulation tétanique, la force continue à
augmenter meme après le plafonnement de la déformation (par contre, la courbe mince cesse d’augmenter à ce
moment là). Ce qui montre la « asynchronicité » de l’action du muscle, par rapport à la stimulation.
Fig. 4 - Portance aérodynamique (« lift ») mésurée sur des insectes vivants durant des cycles de battement
d’ailes, exprimé en % du poids de l’animal, et trace correspondante de la stimulation neuro-musculaire
(EMG=electro-myographic frequency) mésurée par des electrodes insérés dans le corps de l’animal. On voit très
clairement que les deux fréquences sont bien différentes : d’ici le concept de « asyncronicité » entre stimulus
neuronal et contraction musculaire.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%