Télécharger le PDF

Mise au point
Prise en charge initiale d’un œdème pulmonaire cardiogénique
du sujet agé
Acute care of elderly patients with cardiogenic pulmonary edema
E L’Her
a,
*, D Goetghebeur
b
, F Duquesne
c
a
Réanimation et urgences médicales, CHU de la Cavale-Blanche, 29609 Brest cedex, France
b
Réanimation et urgences médicales, unité d’hospitalisation de courte durée – accueil des urgences vitales, CHU de la Cavale-Blanche,
29609 Brest cedex, France
c
Réanimation et urgences médicales, unité d’accueil gériatrique, CHU de la Cavale-Blanche, 29609 Brest cedex, France
Reçu et accepté le 23 août 2004
Résumé
L’insuffisance cardiaque du sujet âgé est une pathologie fréquente. Elle est responsable de nombreuses hospitalisations et d’une mortalité
importante au décours d’un premier épisode d’œdème pulmonaire. Le diagnostic d’œdème pulmonaire cardiogénique est parfois difficile aux
urgences chez un sujet âgé polypathologique. Le dosage du Brain Natriuretic Peptid (BNP) trouve sa place dans l’aide au diagnostic d’une
détresse respiratoire aiguë du sujet âgé, en raison des difficultés diagnostiques et de la pathogenèse intriquée. Dans environ 50 % des cas,
l’échocardiographie mettra en évidence une dysfonction diastolique isolée. Le traitement médical spécifique reste identique quel que soit l’âge
du patient et s’appuie essentiellement sur l’utilisation des dérivés nitrés à forte posologie. La ventilation non invasive administrée aux urgences
ou dès la prise en charge préhospitalière, permet de diminuer la morbidité et la mortalité précoce de l’œdème pulmonaire. Malgré l’âge des
patients, la ventilation mécanique conventionnelle garde sa place en cas d’échec du traitement conventionnel et de la ventilation non invasive.
© 2004 Société de réanimation de langue française. Publié par Elsevier SAS. Tous droits réservés.
Abstract
Heart failure of the elderly patients is a frequent pathology. It is responsible for recurrent hospitalisations and an important mortality rate.
The diagnosis of cardiogenic pulmonary edema may be difficult in elderly patients. Brain Natriuretic Peptide measurement may be useful in
this situation. In more than 50% cases, echocardiography will evidence a diastolic heart failure. Medical treatment mainly relies on high doses
nitrates. Non-invasive ventilation decreases cardiogenic pulmonary edema-induced morbidity and early mortality. Beside patients’ age,
invasive mechanical ventilation may be used when conventional treatment and non-invasive ventilation failed.
© 2004 Société de réanimation de langue française. Publié par Elsevier SAS. Tous droits réservés.
Mots clés : Détresse respiratoire aiguë ; Gériatrie ; Insuffisance cardiaque ; Œdème pulmonaire cardiogénique
Keywords: Acute respiratory failure; Cardiogenic pulmonary edema; Elderly patients; Geriatry
L’œdème pulmonaire cardiogénique (OAP) est une patho-
logie fréquente, responsable de nombreuses hospitalisations
et d’une mortalité importante au décours d’un premier épi-
sode [1–4]. Pourquoi faut-il s’intéresser à l’OAP de la per-
sonne âgée dans un service d’accueil et d’urgence (SAU) ?
Les raisons sont multiples, plus fondées sur une approche
pragmatique que sur des preuves scientifiques solides, car
peu d’études prospectives se sont spécifiquement intéressées
à ce problème :
•les sujets âgés de plus de 75 ans représentent actuellement
plus de8%delapopulation générale dans les pays
* Auteur correspondant.
Adresse e-mail : [email protected] (E. L’Her).
Réanimation 13 (2004) 516–522
http://france.elsevier.com/direct/REAURG/
1624-0693/$ - see front matter © 2004 Société de réanimation de langue française. Publié par Elsevier SAS. Tous droits réservés.
doi:10.1016/j.reaurg.2004.08.009

industrialisés, et chaque jour plus de 5 % d’entre eux sont
hospitalisés ;
•l’insuffisance cardiaque touche essentiellement le sujet
âgé ;
•la mortalité au décours d’un épisode aigu d’insuffisance
cardiaque est liée de façon indépendante à l’âge des pa-
tients [5] ;
•le diagnostic clinique sera parfois difficile chez ces pa-
tients [6] ;
•la prise en charge cardiologique spécialisée ultérieure sera
le plus souvent limitée.
1. Caractéristiques épidémiologiques de l’œdème
pulmonaire cardiogénique du sujet âgé
1.1. Définition du sujet « âgé »
En moins de 20 ans, l’espérance de vie en France a
augmenté de plus d’un an (1,3 ans pour les hommes ; 1,7 ans
pour les femmes). Le seuil définissant la population « âgée »
a varié au cours du temps, un âge de 75 ans étant actuellement
retenu.
Les personnes âgées de plus de 75 ans représentent plus de
8 % de la population et les personnes de plus de 85 ans 2,4 %.
Cette population âgée est majoritairement féminine (2/3 des
personnes âgées de 75 à 84 ans, près de 3/4 des personnes
âgées de 85 ans et plus). Chaque jour, 1,1 % des sujets âgés
de 60 à 69 ans et 5,7 % des plus de 80 ans sont hospitalisés.
1.2. Épidémiologie de l’insuffısance cardiaque
L’incidence annuelle de l’insuffisance cardiaque est de
0/1000 chez les patients de moins de 65 ans, supérieure ou
égale à 20/1000 chez les patients de plus de 75 ans, supé-
rieure à 40/1000 au-delà de 85 ans. Le nombre de réadmissi-
ons hospitalières de patients de plus de 85 ans au décours
d’un premier épisode d’OAP est supérieur à celui observé
chez des patients plus jeunes (plus de 50 % de patients seront
réhospitalisés dans les 3 mois), et les durées d’hospitalisation
sont plus longues [2].
La mortalité de l’insuffisance cardiaque est élevée (16–
20 %). Elle est liée de façon indépendante à l’âge des pa-
tients, d’autant plus élevée que le patient est âgé [5].
Cependant la grande majorité de ces études épidémiologi-
ques sont le plus souvent établies à partir des certificats de
décès (dont la fiabilité du remplissage est souvent douteuse)
et ne tiennent pas compte du caractère aigu ou chronique de
la pathologie. À l’exception de la série EPIDASA, dont les
résultats définitifs n’ont pas encore été publiés [7], nous ne
disposons pas de données fiables sur le nombre réel de
patients âgés admis à l’hôpital pour une détresse respiratoire
aiguë et sur leur devenir.
1.3. Facteurs de décompensation de l’insuffısance
cardiaque du sujet âgé
Lorsqu’un facteur déclenchant est retrouvé, il s’agit
d’écarts de régime, d’une non-compliance au traitement,
d’un trouble du rythme supraventriculaire, d’une poussée
hypertensive [8], d’une infection bronchopulmonaire, mais
plus rarement d’une ischémie myocardique. À ceci s’ajoute
une pathogenèse intriquée, chez un sujet souvent polypatho-
logique [9] : surcharge hydrosodée chez un patient avec
insuffisance rénale latente, exacerbation aiguë d’une bron-
chopathie obstructive associée...
1.4. Fréquence des pathologies cardiorespiratoires
intriquées
La fréquente coexistence de pathologies cardiaques et
respiratoires renforce la difficulté du diagnostic étiologique.
Dans une étude sur 122 patients admis pour décompensation
cardiaque, le diagnostic final d’OAP isolé n’était retenu que
dans 29 % des cas (concordance de trois avis cardiologiques,
du cliché thoracique, de l’échographie cardiaque, du dosage
de BNP). Une BPCO ou une obésité sous-jacentes étaient
considérées comme responsables de 42 % des faux diagnos-
tics [10]. Dans une étude sur 11 000 patients hospitalisés
pour OAP, 54 % des patients étaient âgés de plus de 70 ans et
24 % étaient atteints d’une pathologie pulmonaire chronique
[11]. La fréquence de comorbidités cardiaques est également
retrouvée au cours des décompensations aiguës d’insuffi-
sance respiratoire chronique [12].
1.5. Erreurs diagnostiques attestées à l’autopsie
Une étude autopsique réalisée chez 114 patients centenai-
res a montré que les atteintes cardiovasculaires et respiratoi-
res représentaient les premières causes de décès : pneumonie
infectieuse (35 %), embolie pulmonaire (14 %), insuffisance
cardiaque aiguë (16 %). Le diagnostic initial de la cause du
décès n’était exact que dans 40 % des cas [13]. Le recours
aux outils diagnostiques modernes n’améliorait pas ces mé-
diocres résultats.
2. Diagnostic de l’OAP du sujet âgé
L’OAP cardiogénique est d’origine hydrostatique, lié à
l’augmentation de la pression capillaire pulmonaire par dé-
faillance cardiaque congestive. Il correspond à une augmen-
tation de l’eau extravasculaire pulmonaire lorsque les capa-
cités de drainage lymphatique sont dépassées. L’œdème
interstitiel et l’inondation alvéolaire affectent à la fois les
échanges gazeux (effet shunt) et la mécanique ventilatoire
(baisse de la compliance pulmonaire, augmentation des ré-
sistances bronchiques par œdème pariétal et éventuelle bron-
choconstriction réflexe).
Chez la personne âgée, l’urgentiste sera souvent confronté
à des difficultés d’ordre diagnostique, compte tenu des parti-
cularités et atypies séméiologiques, de difficultés d’interpré-
tation des examens complémentaires et de la fréquence d’une
pathogenèse intriquée chez les sujets âgés.
2.1. La clinique peut être caricaturale
À l’inspection on observe une cyanose, une dyspnée avec
tachypnée et la mise en jeu des muscles respiratoires acces-
517E. L’Her et al. / Réanimation 13 (2004) 516–522

soires ; à l’interrogatoire on retrouve une orthopnée d’aggra-
vation progressive et/ou la survenue d’un facteur déclen-
chant. La tachycardie est habituelle. L’examen clinique
objective une hypertension artérielle systolodiastolique, des
râles crépitants fins, généralisés ou localisés dans les deux
bases. On observe classiquement, une expectoration mous-
seuse, « saumonée ».
2.2. La clinique est souvent moins évocatrice [6]
L’interrogatoire est difficile en cas de troubles des fonc-
tions supérieures ou de détresse respiratoire aiguë. Il peut
exister une bronchorrhée purulente, de la fièvre (infection
bronchopulmonaire associée), une hypotension artérielle
(choc cardiogénique), des râles sibilants (œdème bronchi-
que, bronchoconstriction réflexe, exacerbation associée
d’une bronchopathie chronique). Le patient est parfois bra-
dycarde en raison de traitements associés. L’expectoration
rosée est souvent absente.
La sémiologie des maladies cardiorespiratoires est égale-
ment très souvent trompeuse chez le sujet âgé [14].La
corrélation entre les plaintes fonctionnelles (dyspnée, dou-
leur thoracique notamment) et les anomalies retrouvées à
l’examen physique est médiocre, un même symptôme pou-
vant être observé au cours de diverses maladies. Contraire-
ment aux idées reçues, la présence d’une orthopnée n’est pas
un argument fort en faveur d’un OAP. En effet, le diaphragme
est dans une meilleure conformation géométrique pour se
contracter chez le patient en position assise, ceci quelle que
soit la pathologie causale de la dyspnée. Les sibilants sont
entendus au cours d’une crise d’asthme, une exacerbation de
BPCO, un œdème pulmonaire cardiogénique (asthme cardia-
que), voire même chez les patients présentant une embolie
pulmonaire [15]. L’auscultation de râles crépitants en décu-
bitus peut n’avoir aucune signification pathologique, en par-
ticulier chez le patient obèse.
C’est le contexte général et la connaissance des antécé-
dents du patient, associés aux résultats d’un traitement pro-
babiliste initial et des examens complémentaires, qui permet-
tent le diagnostic d’OAP. Dans une étude sur les OAP du
sujet âgé, un diagnostic initial d’atteinte pulmonaire, évoqué
en raison de l’existence d’un bronchospasme, s’avérait er-
roné dans 16 % des cas [1].
2.3. Limites des examens complémentaires de routine
Outre les problèmes séméiologiques évoqués précédem-
ment, les difficultés diagnostiques sont également liées au
manque de rentabilité clinique des différents examens com-
plémentaires de routine.
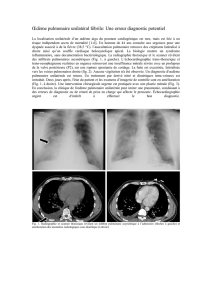
2.3.1. Cliché thoracique
Un cliché réalisé au lit permet habituellement de confir-
mer le diagnostic d’OAP. Il objective le plus souvent des
anomalies bilatérales : une redistribution vasculaire vers les
sommets avec atténuation des trois zones de West, des lignes
de Kerley B, un flou périvasculaire, puis des opacités alvéo-
laires diffuses, à prédominance périhilaire, en « aile de pa-
pillon ». Il peut être trompeur chez le sujet âgé hospitalisé
pour une insuffisance respiratoire aiguë : mauvaise pénétra-
tion des rayons rendant difficile la mise en évidence de la
redistribution vasculaire en cas d’insuffisance ventriculaire
gauche, œdème pulmonaire à prédominance unilatérale,
pseudocondensations, superposition d’artefacts cutanés,
élargissement du médiastin avec aorte calcifiée et déroulée,
cyphoscoliose, séquelles thoracoparenchymateuses de pa-
thologies antérieures (tuberculose, collapsothérapie, fractu-
res de côtes...). L’index cardiothoracique est ininterprétable
sur un cliché réalisé aux urgences car l’incidence du rayon
(antéropostérieur) élargit la silhouette cardiaque par rapport
à un cliché conventionnel (d’environ 15 % en moyenne) [16].
Dans une étude portant sur 104 patients suspects d’OAP,
les données obtenues par la radiographie thoracique, inter-
prétée de façon indépendante par trois radiologues, ont été
comparées à la pression télédiastolique ventriculaire gauche
mesurée par cathétérisme cardiaque. Dans plus d’un tiers des
cas où un OAP était prouvé, la radiographie était considérée
comme strictement normale [17].Affirmer radiologiquement
l’existence d’un œdème pulmonaire cardiogénique chez un
patient BPCO est aussi très difficile [18].
2.3.2. Les gaz du sang artériels
Si les gaz du sang artériels sont très fréquemment réalisés
en routine dans nos unités d’urgence, leur utilité d’un point
de vue pratique lors de la prise en charge d’un patient en
détresse respiratoire aiguë n’est pas évidente [19,20], com-
parativement à l’utilité de la surveillance de la saturation de
pouls en oxygène (SpO
2
). Ils permettront toutefois une orien-
tation diagnostique et permettront seuls de confirmer l’exis-
tence d’une hypercapnie.
Les valeurs du pH et de la PaCO
2
ne sont pas modifiées
chez les personnes âgées [21,22]. Si une étude ancienne avait
noté une diminution progressive de la PaO
2
avec l’âge [23],
donnée considérée comme acquise en pratique courante, des
travaux plus récents ont montré que la PaO
2
reste stable en
l’absence de pathologie respiratoire chronique [24,25].
L’existence d’un effet shunt gazométrique se rencontre
dans toute anomalie des rapports ventilation/perfusion, que
le patient présente un œdème pulmonaire cardiogénique, une
embolie pulmonaire ou encore une pneumopathie. La pré-
sence d’une hypercapnie n’est pas spécifique d’une décom-
pensation aiguë d’insuffisance respiratoire chronique. Cin-
quante pour cent des patients âgés hospitalisés pour un
œdème pulmonaire cardiogénique sont hypercapniques à
l’admission, y compris en l’absence d’insuffisance respira-
toire chronique [6]. Le niveau d’hypercapnie a moins d’im-
portance que la cinétique de l’augmentation de la PaCO
2
et/ou la baisse du pH, spontanément ou sous traitement.
Chaque gazométrie programmée devrait faire poser l’indi-
cation d’une analgésie locale, que celle-ci soit réalisée par
injection sous-cutanée de lidocaïne, ou par patch transdermi-
que, compte-tenu du caractère douloureux de ce type de
prélèvement [26].
518 E. L’Her et al. / Réanimation 13 (2004) 516–522

2.3.3. L’électrocardiogramme (ECG)
Si la réalisation d’un ECG est indispensable afin de re-
chercher un facteur déclenchant (ischémie myocardique,
trouble du rythme supraventriculaire...), sa valeur diagnosti-
que est très faible, prise isolément dans ce contexte. La mise
en évidence de troubles du rythme permet d’entreprendre un
traitement étiologique. Dans une étude prospective réalisée
chez 71 patients hospitalisés aux urgences pour une dyspnée
aiguë, Gillespie et al. ont déterminé la sensibilité et la spéci-
ficité respectives des examens usuels utilisés afin de porter le
diagnostic d’OAP [27]. Dans cette étude, les examens com-
plémentaires comme l’ECG, étaient considérés pour l’ana-
lyse comme non contributifs (ECG normal ou par ex. en cas
d’extrasystoles isolées) ou comme contributifs (troubles du
rythme ventriculaire ou auriculaire, de conduction, de repo-
larisation...). Selon les auteurs, la sensibilité (Se) de l’exa-
men clinique seul était évaluée à 81 %, avec une spécificité
(Sp) à 47 %. L’ECG pris isolément était crédité d’une Se
= 98 %, avec une Sp = 69 %. L’association examen clinique
et ECG était créditée d’une Se = 98 % et d’une Sp = 76 %.
L’association examen clinique, ECG et cliché thoracique
permettait selon eux de porter le diagnostic d’OAP avec une
Se = 100 % et une Sp = 95 %. Ces performances, somme
toutes assez bonnes, mériteraient une réévaluation à plus
grande échelle.
2.3.4. Apport diagnostique de l’échocardiographie
Elle permet le diagnostic d’insuffisance cardiaque (altéra-
tion de la fonction systolique, dyskinésie étendue, cardiopa-
thie hypertrophique...) mais reste difficile à obtenir en routine
(disponibilité des opérateurs, problèmes d’échogénécité des
patients, agitation...) et ne sera donc réalisée lors de la prise
en charge initiale qu’en cas de doute diagnostique. La mise
en évidence d’une fonction systolique conservée n’élimine
pas le diagnostic d’OAP [28,29]. Un trouble isolé de la
fonction diastolique serait observé chez plus de 50 % des
patients admis en urgence pour OAP [8].
2.3.5. Dosage du Brain Natriuretic Peptid (BNP)
Le BNP est un peptide libéré dans le sang en cas d’étire-
ment des myocytes ventriculaires. L’intérêt de son dosage est
vraisemblable chez un sujet âgé polypathologique pour le-
quel le diagnostic s’avère difficile [30,31]. Dans une étude
récente sur 1586 patients, son taux sanguin était significati-
vement plus élevé en cas de dyspnée d’origine cardiaque, par
rapport aux patients présentant une dyspnée d’origine pul-
monaire [32]. Son dosage s’avérait supérieur, en termes de
pertinence diagnostique, aux données cliniques et paraclini-
que : VPP = 83,4 % (taux ≥100 pmol/ml) ;VPN = 96 % (taux
< 50 pmol/ml).
3. Traitement de l’OAP du sujet âgé
Les buts du traitement d’un patient en détresse respiratoire
aiguë sur un OAP sont :
•de soulager rapidement le patient ;
•d’assurer l’oxygénation tissulaire ;
•d’accélérer la résorption de l’eau pulmonaire extravascu-
laire ;
•de traiter un éventuel facteur déclenchant.
Il existe peu d’essais randomisés permettant d’affirmer l’adé-
quation de thérapeutiques proposées à la situation du sujet
âgé présentant des troubles de la fonction diastolique et/ou
des pathologies intriquées.
3.1. Traitement symptomatique de l’insuffısance
respiratoire aiguë
3.1.1. L’oxygénothérapie
Selon des données anciennes, l’administration d’oxygène
au patient hypoxémique aurait pour effet de diminuer l’im-
portance des influx nerveux afférents provenant des chémo-
récepteurs. La ventilation se trouverait alors diminuée par
une moindre stimulation de la commande centrale, d’où la
survenue d’une hypercapnie chez certains patients. Si la
baisse de la ventilation est effective après mise en route de
l’oxygénothérapie, il ne faut cependant que quelques minu-
tes pour qu’elle retrouve son niveau préalable [33,34].
L’objectif de l’oxygénation est d’obtenir une saturation
artérielle en oxygène (SaO
2
)≥90 %, dans des conditions
normales de pH et de température. Du fait de la relation
sigmoïde entre la SaO
2
et la pression artérielle partielle en
oxygène (PaO
2
), ce niveau de saturation correspond à une
PaO
2
de 60 mmHg. Cet objectif doit être la priorité du
clinicien, y compris chez le patient hypercapnique à l’admis-
sion, que cette hypercapnie soit aiguë (par épuisement respi-
ratoire) ou chronique (cas du patient insuffisant respiratoire
chronique obstructif par ex.). Dans la grande majorité des
cas, l’augmentation de la PaCO
2
ne s’observe pas ou reste
modérée. Dans une série de patients âgés admis aux urgences
pour OAP (âge = 84 ± 6 ans), le niveau de PaCO
2
initialement
élevé chez un tiers des patients (> 50 mmHg) diminuait très
rapidement sous traitement médical, malgré une oxygéno-
thérapie initiale à haut débit (F
I
O
2
> 60 % dans tous les cas)
[35]. Chez les patients qui aggravent leur capnie avec chute
du pH, il est préférable de mettre en œuvre une assistance
ventilatoire (non invasive en première intention), plutôt que
de tolérer des niveaux d’oxygénation à risque [34].
Compte-tenu de l’objectif de SaO
2
, l’oxygène sera initia-
lement administré à haut débit (8–15 l/min), en utilisant un
masque à haute concentration.
3.1.2. Traitement pharmacologique de la dyspnée
Plusieurs études ont mis en évidence une diminution de la
dyspnée des patients souffrant de bronchopathie chronique
obstructive ou d’insuffisances cardiaques à l’état stable, ou
des patients en phase terminale de cancers, lors de l’adminis-
tration d’opiacés [36,37]. L’utilisation de la morphine à la
phase aiguë de l’œdème pulmonaire cardiogénique fait partie
intégrante du traitement médical conventionnel [3], y com-
pris en l’absence de syndrome coronarien sous-jacent et sera
donc abordée dans ce chapitre.
519E. L’Her et al. / Réanimation 13 (2004) 516–522

3.1.3. Mise en route d’une assistance ventilatoire
Les indications et la conduite de l’assistance ventilatoire
au cours des insuffisances respiratoires aiguës ont été modi-
fiées par l’introduction de la ventilation non invasive au début
des années 1990. Mais il y a plus de 60 ans, des études
cliniques suggéraient déjà que l’application d’une PEP chez
des patients en insuffisance cardiaque permettait de diminuer
la dépression pleurale à l’inspiration (autre reflet du travail
respiratoire fourni par les patients), diminuait les pressions
de remplissage ventriculaires et la congestion pulmonaire
[38,39] et améliorait l’évolution clinique [40].
Compte-tenu des complications graves et fréquentes en
rapport avec le caractère invasif de l’assistance ventilatoire
sur sonde endotrachéale, la ventilation non invasive pourrait
s’avérer une technique de choix, en première intention, chez
des sujets âgés polypathologiques pour lesquels un transfert
en réanimation n’est pas toujours souhaitable (ou souhaité).
3.1.3.1. Ventilation non invasive. La ventilation non invasive
a fait la preuve de son efficacité en termes d’amélioration
rapide des gaz du sang artériels et des signes cliniques de
détresse respiratoire aiguë, ou de diminution de la mortalité
et de la morbidité, au cours de détresses respiratoires aiguës
d’étiologies variées [41].
Les objectifs de la ventilation non invasive chez le sujet
âgé en détresse respiratoire aiguë seront d’assurer une assis-
tance ventilatoire efficace sans recours à une intubation en-
dotrachéale, d’éviter les complications secondaires à l’intu-
bation et à la sédation prolongée, de ralentir l’évolution de
l’insuffisance respiratoire aiguë vers une situation plus grave,
d’améliorer le confort des patients et enfin d’éviter une évo-
lution fatale, y compris chez les patients pour lesquels une
intubation est refusée [42].
La première indication de la ventilation non invasive au
cours de la détresse respiratoire aiguë du sujet âgé admis aux
urgences, est très certainement par ordre de fréquence
l’œdème pulmonaire cardiogénique [43]. Plusieurs études
ont démontré l’intérêt potentiel de la VNI utilisant soit la
CPAP soit l’aide inspiratoire, en termes d’amélioration clini-
que et biologique initiale ainsi qu’en termes de réduction du
taux d’intubation [44,45]. Des études récentes ont malgré
tout illustré le fait que cette amélioration initiale ne permet-
tait pas de modification du pronostic global des patients
[35,46].
Ceci revient cependant à se poser la question du lieu où
pourra être initiée la ventilation non invasive, exclusivement
en réanimation ou également aux urgences et en préhospita-
lier ? Ce sujet fait encore l’objet de nombreuses controverses
et l’utilisation de la ventilation non invasive reste encore peu
fréquente en médecine d’urgence [47].
3.1.3.2. Assistance ventilatoire invasive sur sonde endotra-
chéale. En cas de survenue de troubles de la conscience,
d’hypoxémie réfractaire ou d’instabilité hémodynamique, le
recours à la ventilation mécanique invasive après intubation
endotrachéale s’avère nécessaire d’un point de vue stricte-
ment médical. Chez des patients âgés (médiane = 82 ans)
intubés pour une détresse respiratoire aiguë sur un œdème
pulmonaire cardiogénique, Adnet et al. ont observé une mor-
talité intrahospitalière de 27 %, ainsi qu’un retour à domicile
dans un état clinique superposable à leur état antérieur dans
50 % des cas [48]. Dans cette indication particulière, le
recours à une assistance ventilatoire invasive peut être envi-
sagé chez un sujet âgé, après échec du traitement médical
conventionnel et de la ventilation non invasive, avec un taux
de survie acceptable à long terme (70 % de survie à 1 an).
3.2. Traitement médical conventionnel
Le traitement médical de l’OAP est assez bien codifié,
intégrant des vasodilatateurs préférentiellement veineux (dé-
rivés nitrés), des diurétiques et de la morphine [49].Lecas
particulier de la mise en route des IEC et inotropes positifs
sera également abordé.
3.2.1. Dérivés nitrés
Ils ont un effet vasodilatateur mixte, essentiellement vei-
neux, et vont diminuer la précharge, la postcharge ventricu-
laire gauche ainsi que la demande myocardique en oxygène.
Par ailleurs, ils sont doublement utiles lors de cardiopathies
ischémiques décompensées de par leur effet vasodilatateur
coronarien.
La voie d’action la plus rapide (< 2 minutes) est la voie
sublinguale, disponible avant même la pose d’une voie vei-
neuse (2 à 3 sprays à répéter en fonction de la tension
artérielle). La poursuite du traitement sera assurée par voie
intraveineuse, même si dans les cas les moins graves le
traitement sublingual peut s’avérer suffisant [50] ou le relais
par la voie transcutanée discuté. Dans une étude randomisée,
Cotter et al. comparaient l’efficacité et la sécurité du furosé-
mide et des dérivés nitrés à différentes posologies. En cas de
tension artérielle normale ou élevée, une dose importante de
nitrés administrée en bolus (3 mg IV, renouvelés toutes les
5 minutes) associée à 40 mg de furosémide, s’avérait plus
efficace qu’une dose élevée de furosémide (80 mg IV, éven-
tuellement renouvelé toutes les 15 minutes) associée à une
faible dose de nitrés en continu (1 mg par heure, augmentée
de 1 mg par heure toutes les 10 minutes), en termes de
réduction des ischémies aiguës et de recours à la ventilation
mécanique [51].
3.2.2. Diurétiques
L’utilisation « traditionnelle » de furosémide a pour but de
diminuer la congestion pulmonaire et d’augmenter la diurèse
des patients. L’injection intraveineuse de diurétiques a un
effet clinique net avec une diminution rapide de la pression
capillaire pulmonaire, bien avant la survenue de l’effet diu-
rétique (≥20 minutes). Compte-tenu de l’efficacité supé-
rieure des vasodilatateurs nitrés, ainsi que des effets secon-
daires potentiels des diurétiques chez des sujets âgés, en
particulier en cas de dysfonction diastolique (hyponatrémie,
hypokaliémie, aggravation de la fonction rénale), les diuréti-
520 E. L’Her et al. / Réanimation 13 (2004) 516–522
 6
6
 7
7
1
/
7
100%