NOTICE: INFORMATION DE L`UTILISATEUR Iodure de

NOTICE: INFORMATION DE L’UTILISATEUR
Iodure de potassium RPH Pharmaceuticals 65 mg comprimés
Iodure de potassium
Veuillez lire attentivement cette notice avant de prendre ce médicament. Elle contient des
informations importantes pour votre traitement.
Ce médicament est disponible sans prescription médicale. Toutefois, vous devez toujours prendre
l’Iodure de potassium RPH Pharmaceuticals avec prudence pour en obtenir les meilleurs effets.
- Gardez cette notice. Vous pourriez avoir besoin de la relire.
- Si vous avez besoin de plus d’informations et de conseils, adressez-vous à votre
Pharmaceuticalscien.
- Si les symptômes s’aggravent ou persistent consultez un médecin.
- Si l’un des effets indésirables devient grave ou si vous remarquez tout effet indésirable non
mentionné dans cette notice, parlez-en à votre médecin ou votre Pharmaceuticalscien.
Dans cette notice:
1. Qu’est-ce que l’Iodure de potassium RPH Pharmaceuticals et dans quel cas est-il utilisé
2. Quelles sont les informations à connaître avant de prendre l’Iodure de potassium RPH
Pharmaceuticals?
3. Comment prendre l’Iodure de potassium RPH Pharmaceuticals?
4. Quels sont les effets indésirables éventuels
5. Comment conserver l’Iodure de potassium RPH Pharmaceuticals?
6. Informations supplémentaires
1. QU’EST-CE QUE L’IODURE DE POTASSIUM RPH PHARMACEUTICALS ET DANS
QUEL CAS EST-IL UTILISE
Les comprimés d’iode sont destinés aux populations habitant près d’un réacteur nucléaire en cas de
libération d’iode radioactif dans l’atmosphère suite à un accident dans la centrale nucléaire. Les
comprimés sont utilisés comme traitement prophylactique contre les effets sur la thyroïde.
En cas d’accident nucléaire, les autorités transmettent par radio les consignes d’utilisation des
comprimés d’iode.
Les comprimés ne protègent pas contre les autres types de radiations provenant de substances
radioactives.
L’accumulation d’iode radioactif dans la thyroïde peut être bloquée par une rapide administration
d’une forte dose d’iodure de potassium. La thyroïde, ainsi saturée en iode stable, ne peut plus
absorber d’iode radioactif. Le risque de cancer thyroïdien après une exposition à de l’iode radioactif
est supérieur chez les sujets jeunes. Les groupes les plus à risque sont les fœtus au-delà de la 12e
semaine de gestation, les nouveau-nés et les enfants parce que, chez les jeunes sujets, la thyroïde est
encore en croissance.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER DE
L’IODURE DE POTASSIUM RPH PHARMACEUTICALS
Ne prenez jamais l’Iodure de potassium RPH Pharmaceuticals
- si vous êtes allergique (hypersensible) à l’iodure de potassium ou à l’un des autres consistuants
contenus dans l’Iodure de potassium RPH Pharmaceuticals.
1

- si vous souffrez d’une dermatite herpétiforme, pour laquelle l’administration d’iode est à
prescrire.
2

Faites attention avec l’Iodure de potassium RPH Pharmaceuticals
- si vous souffrez d’une allergie connue à l’iode. Contactez votre médecin avant l’utilisation de ce
médicament.
Veuillez consulter votre médecin si une des mises en garde mentionnées ci-dessus est d’application
pour vous, ou si elle l’a été dans la passé.
Prise d’autres médicaments
Si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans
ordonnance, parlez-en à votre médecin ou à votre Pharmaceuticalscien.
Grossesse et allaitement
Les femmes enceintes ou qui allaitent ne doivent pas prendre plus de deux doses.
Demandez conseil à votre médecin ou à votre Pharmaceuticalscien avant de prendre tout médicament.
Informations importantes concernant certains composants de l’Iodure de potassium RPH
Pharmaceuticals
L’Iodure de potassium RPH Pharmaceuticals contient du lactose. Si votre médecin vous a informé(e)
d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
3. COMMENT PRENDRE L’IODURE DE POTASSIUM RPH PHARMACEUTICALS
La prise de comprimés d'iode ne doit avoir lieu qu'à l'invitation expresse des autorités ou de l'Institut
national de protection contre les radiations.
Respectez toujours la posologie indiquée par votre médecin.
Pour obtenir une protection optimale, la dose doit être prise aussitôt que possible après l'annonce des
rejets d'iode radioactif.
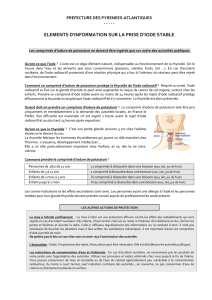
La dose habituelle est:
Adultes de moins de 40 ans et enfants de plus de 12 ans: 2 comprimés
Enfants de 3 à 12 ans : 1 comprimé
Enfants de 1 mois à 3 ans : 1/2 comprimé
Nouveau-né (moins de 1 mois) : 1/4 de comprimé
Le comprimé peut être croqué ou avalé. Pour le nouveau-né et le nourrisson, la dose peut être écrasée
et dissoute dans de l’eau, de la limonade ou similaire. En cas d’exposition prolongée aux radiations,
une nouvelle dose pourra être prise dans les 2 jours qui suivent. Les autorités compétentes donneront
des informations au sujet de cette.
Les nouveau-nés ne doivent pas recevoir plus d'une dose. La prise de comprimés d’iodure de
potassium n’est pas indiquée chez l’adulte de plus de 40 ans car aucune augmentation du risque de
cancer thyroïdien n’a été observée dans ce groupe d’âges après une exposition à de l’iode radioactif.
Si vous avez pris plus de l’Iodure de potassium RPH Pharmaceuticals que vous n’auriez dû
Si vous avez utilisé ou pris trop de l’Iodure de potassium RPH Pharmaceuticals, prenez
immédiatement contact avec votre médecin, votre pharmacien ou le centre Antipoison (070/245.245).
Les personnes précédemment traitées pour une thyrotoxicose ou une inflammation de la thyroïde qui
reçoivent des doses importantes d'iode risquent une hypothyroïdie permanente. Pour les personnes qui
suivent un traitement aux hormones thyroïdiennes, il n'y a pas de risque accru d'effets indésirables.
Si vous avez des questions sur l’emploi de ce médicament, demandez conseil à votre médecin ou votre
pharmacien.
3

4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS
Comme tous les médicaments, l’Iodure de potassium RPH Pharmaceuticals peut provoquer des effets
indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Rares (moins d’1 sujet sur 1000): éruption cutanée. L’éruption cutanée est transitoire.
Si vous ressentez un des effets mentionnés comme grave ou si vous présentez des effets indésirables
non mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
5. COMMENT CONSERVER L’IODURE DE POTASSIUM RPH PHARMACEUTICALS
Tenir hors de la portée et de la vue des enfants.
Ne pas utiliser l’ Iodure de potassium RPH Pharmaceuticals après la date de péremption mentionnée
sur la boîte/la plaquette thermoformée après « EXP ». La date d’expiration fait référence au dernier
jour du mois.
Les comprimés peuvent légèrement jaunir au cours du stockage. Cette décoloration n’a aucun effet sur
l’efficacité de la prévention.
Les médicaments ne doivent pas être jetés au tout à l’égout ou avec les ordures ménagères. Demandez
à votre pharmacien ce qu’il faut faire des médicaments inutilisés. Ces mesures permettront de protéger
l’environnement.
6. INFORMATIONS SUPPLEMENTAIRES
Que contient l’Iodure de potassium RPH Pharmaceuticals
- La substance active est iodure de potassium 65 mg (correspondant à 50 mg d’iode)
- Les autres composants sont lactose anhydre 176 mg, cellulose microcristalline, stéarate de
magnésium
Qu’est ce que l’Iodure de potassium RPH Pharmaceuticals et contenu de l’emballage extérieur
L’Iodure de potassium RPH Pharmaceuticals sont blancs, plats, quadrisécables, diamètre de 9 mm.
Les comprimés sont disponibles en boîtes de 10 comprimés sous plaquette thermoformée.
Titulaire de l’Autorisation de mise sur le marché et fabricant
Titulaire de l’AMM
RPH Pharmaceuticalsceuticals AB
Lagervägen 7
SE-136 50 Jordbro
Suède
Fabricant
Recipharm Stockholm AB
Bränningevägen 10-24
SE-120 54 Årsta
Suède
Représentant Local
Laboratoria Qualiphar N.V./S.A.
Rijksweg 9
B-2880 Bornem
Numéro de l’autorisation de mise sur le marché: BE206857
Délivrance libre.
4

Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les
noms suivants :
Belgique, Luxembourg: Iodure de Potassium RPH Pharmaceuticals 65 mg , comprimés
Norvège, Suède: Kaliumjodid RPH Pharmaceuticals
La dernière date à laquelle cette notice a été approuvée est 08/2012.
5
1
/
5
100%