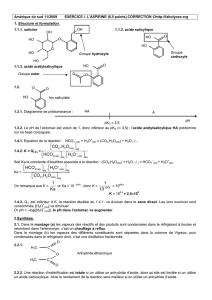
° = C soluté a γ

1
(ce n’est pas le cours !)
Chapitre 1 : La réaction chimique
I Réactifs-réactants
Convention d’écriture :
A A + B B
C C + D D
A et B : réactifs
C et D : produits
Autres notations pour la réaction
réactifs produits
réactifs produits
réactifs produits
réactifs produits
II Potentiel chimique
Potentiel chimique d’un composé :
Chacun des constituants de la réaction est caractérisé par une énergie
A,B C et D
Potentiel chimique :
Pour un soluté
C
soluté
a
C° = 1 mol. L-1
coefficient d’activité (sans dimension)
exprimée en mol. L-1
III sens de réaction - constante d’équilibre

2
avancement
de la réaction
potentiels
produits
potentiels
réactifs
minimum
d'énergie
position
d'équilibre
Situations envisageables :
avancement
de la réaction
potentiels
produits
potentiels
réactifs
position
d'équilibre
avancement
de la réaction
potentiels
produits
potentiels
réactifs
position
d'équilibre
A A + B B C C + D D
A A + B B C C + D D
avancement
de la réaction
potentiels
produits
potentiels
réactifs
position
d'équilibre
avancement
de la réaction
potentiels
produits
potentiels
réactifs
position
d'équilibre
A A + B B C C + D D
A A + B B C C + D D
Expressions analytiques de la constante associée à la réaction :
A A + B B C C + D D
B
D
A
C
ν
B
ν
D
ν
A
ν
Ca
a
a
a
K
BA
DC
νν
νν
BA
DC
K
IV Exemples de réactions étudiées dans ce cours :

3
a - Convention d’écriture
b - Dissolution du chlorure de sodium dans l’eau
NaCl(s) H2ONa
(+)
aq Cl(-)
aq
+
ClNa
a
a
a
a
K
solvO,H
aqCl
sNaCl,
aq,Na
2
,-
c - Dissolution de l’acide acétique (ou éthanoïque) dans l’eau.
H3C
O
O H
H2O
+H3C
O
O
H3O
+
(-)
(+)
1
OH
HCOCH COCH
a
a
a
a
K)(
3
23
)(
23
solvO,H
aqOH
aqH,COCH
aq,COCH
2
3
23
-
23
V Différents types de réaction
Chapitre 2 : réaction acide-base
I Généralités – aspect qualitatif
1) différents modèles
- a) modèle d’Arrhénius
base : espèce chimique capable de libérer des OH(-) dans l’eau
acide : espèce capable de libérer des H(+) dans l’eau
inconvénient de ce modèle :
ne permet pas d’expliquer simplement la basicité de composés non oxygénés comme
l’ammoniac.
- b) modèle de Lewis (le plus général)
acide : espèce chimique possédant une orbitale vide
base : espèce chimique possédant un doublet non-liant
réaction acide-base au sens de Lewis :

4
B.
.
A
+
BA
Base
de Lewis
Acide
de Lewis
Complexe de
Lewis
type de réaction : donneur-accepteur
B.
.A
(la base donne son doublet électronique non-liant, l’acide le reçoit)
Ex :
Et O
Et
BH3
Et O
Et
BH3
(+) (-)
- c) modèle Brønsted-Lowry
(permet de faire des calculs en solution)
acide : libère des H(+)
base : capte des H(+)
2) Etude du modèle Brønsted-Lowry
Caractère acide :
AH A(-) (+)
+H
AH : espèce acide
A(-) : base conjuguée

5
Ce qui se passe chimiquement :
A H A
(-) (+)
+H
.
.
un acide sera d’autant plus « fort » qu’il est ionisé (dissocié)
Caractère basique :
(+)
+HBH(+)
B
B : espèce basique
BH(+) : acide conjugué
Ce qui se passe chimiquement :
B.
.(+)
+H(+)
B H
une base sera d’autant plus forte qu’elle est protonée
Exemple 1 :
Chlorure d’hydrogène (gaz)
HCl gCl g
(-) (+)
+H g
A l’état gazeux, HCL est un acide faible
Exemple 2 :
Eau
(liquide)
H2O l+H3O aq
(+) +HO aq
(-)
H2O l
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
1
/
37
100%