Stéréochimie

Stéréochimie
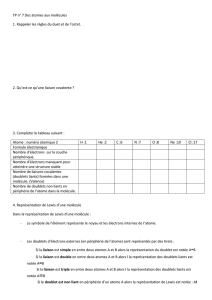
I. Enoncé
I – a. L’élément azote N a pour numéro atomique Z = 7.
Donner sa formule électronique.
En déduire le structure de Lewis de l’atome d’azote.
b. Donner la structure de Lewis de la molécule d’ammoniac : NH
3
.
c. En déduire la géométrie prévue pour cette molécule par la
méthode VSEPR, après avoir expliqué le principe de la méthode.
II- On considère la molécule d’hydrazine H
2
N – NH
2
.
a. Donner la formule de Lewis de cette molécule, et sa géométrie
autour de chaque atome d’azote.
b. Représenter maintenant la molécule d’éthane dans sa
conformation décalée.
III – On considère les molécules suivantes :
a. Une seule de ces molécules présente un atome de carbone
asymétrique : laquelle et pourquoi ?
b. Représenter dans l’espace les deux énantiomères de cette
molécule.
c. Quelle est la fonction chimique présente dans la molécule A ?
II. Corrigé
I – a. Le numéro atomique de l’atome d’azote est 7, cet atome
possède donc 7 protons. De plus un atome est électriquement neutre
donc l’atome d’azote a 7 électrons dans son cortège électronique. En
respectant les règles de remplissage
des couches, on obtient :
Formule électronique : K2L5
Pour déterminer la structure de Lewis, on ne tient compte que de la
dernière couche électronique qui est constituée d’un doublet et de trois
électrons célibataires.
structure de Lewis :
b. Pour déterminer la formule de Lewis d’une molécule, il faut :
- déterminer la structure de Lewis de chacun des atomes
constituant cette molécule,
- faire en sorte que la structure de Lewis de la molécule fasse
respecter la règle de l’octet aux atomes constitutifs (règle du
duet pour l’atome d’hydrogène).
Structure de Lewis de l’atome d’hydrogène :
Structure de Lewis de l’atome d’azote :
Structure de Lewis de la molécule d’ammoniac :
c. La méthode VSEPR est basée sur le principe suivant : les doublets
d’électrons (qu’ils soient libres ou qu’ils rentrent dans une liaison
covalente) subissent une répulsion électrostatique. Ces doublets
vont donc se placer de manière à minimiser au maximum cette
force de répulsion.
Dans le cas où l’atome central d’une molécule est entouré de
quatre doublets d’électrons, d’après la méthode VSEPR, l’atome
central vient se placer au centre d’un tétraèdre régulier. Comme
l’un des doublets est libre, on
obtient une pyramide à
base triangulaire :
II – a. Les formules de Lewis des atomes d’azote et d’hydrogène
ont été données précédemment. Pour vérifier la règle de l’octet ou
du duet, les atomes vont se placer de la manière suivante :
Ce qui donne la
structure de Lewis
suivante :
La géométrie autour de chaque atome d’azote est la même que celle
de la molécule d’ammoniac : pyramidale à base
triangulaire.
c. Conformation décalée de la molécule
d’éthane en projection de Newman :
Dans la conformation décalée, les atomes se placent de manière à
être le plus éloignés les uns des autres.
d. La molécule d’hydrazine présente une conformation décalée car il
y a une libre rotation autour de la liaison simple N – N et que cette
conformation est la plus stable.
Conformation décalée de la molécule
d’hydrazine en projection de Newman :
III – a. La molécule B est la seule à posséder un atome de carbone
asymétrique : le C* est le seul a posséder 4 groupements différents
autour de lui ( - CH3 ; - NH2 ; - H ; - C2H5) :
b.
c. La fonction chimique représentée dans la molécule A est la
fonction amide.
Editeur : MemoPage.com SA © / 2006 / Auteur : Emmanuel Parras
1
/
1
100%