P2-UE-3-Do-Van-Lanh-traitement-médicamenteux-SNC

UE 3 – Traitements médicamenteux
Date : 30/08/2016 Plage horaire : 14h - 16h
Promo : P2 2016/2017 Enseignant : Dr. Do Van Lanh
Ronéistes : DROUET Priyanka
IBRAHIM Ilmmah
PHARMACOLOGIE DES SYSTEMES
SYSTEME NERVEUX CENTRAL
I. Définition des neurotransmetteurs
II.Neuromédiateurs centraux
1. Substances neurotransmettrices an niveau du système nerveux central
2. Exemple de neurotransmetteurs et pathologies impliquées
III.Acides aminés et pathologies impliquées
1. Epilepsie
A. Définition & Généralités
B. Mode d’action des médicaments antiépileptiques
C. Conduite du traitement
D. Education du patient
IV. Monoamines et pathologies impliquées
1. Maladie du Parkinson
A. Définition
B. Le système dopaminergique
C. Traitements antiparkinsoniens
2. Maladie d’Alzheimer
A. Définition
B. Traitement de la maladie
3. Médicaments utilisés dans les nausées et vomissements
4. La Schizophrénie
A. Définition & Généralités
B. Traitement de la maladie par les neuroleptiques (psychotropes)
C. Autres indications thérapeutiques
D. Les correcteurs
5. La Dépression
A. Définition
B. Traitement de la dépression
V. Neuropeptides et douleurs (non traité)
VI. Mauvaise utilisation des MDTs et dépendance (non traité) VII.
VII.Conclusion
sur 128

Cette année c’est plus une approche du SNC. Cette année on insistera plus sur la pharmacociné-
tique, on verra cela au prochain cours.
I. Définition des neurotransmetteurs : « messagers
chimiques »
Un neurotransmetteur est une substance chimique qui assure la transmission de l’influx nerveux au
niveau de la synapse.
!
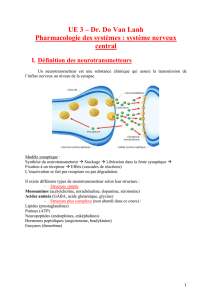
Modèle synaptique :
Synthèse du neurotransmetteur︎-> Stockage->︎Libération dans la fente synaptique︎ Fixation à un ré-
cepteur︎-> Effets (cascades de réactions)
L’inactivation se fait par recapture ou par dégradation. (non dit)
Il existe différents types de neurotransmetteur selon leur structure :
- Structure simple :
Monoamines (acétylcholine, noradrénaline, dopamine, sérotonine)
Acides aminés (GABA, acide glutamique, glycine)
- Structure plus complexe (non abordé dans ce cours) :
Lipides (prostaglandines)
Purines (ATP)
Neuropeptides (endorphines, enképhalines)
Hormones peptidiques (angiotensine, bradykinine)
Enzymes (thrombine)
sur 228

II. Neuromédiateurs centraux
1.Substances neurotransmettrices au niveau système nerveux central
!
Ici on a un schéma avec un neurone avec tout ceux qui gravitent autour et les neurotransmetteurs
qu’on retrouve au niveau SNC (je ne vais pas trop m’attarder dessus parce que ça sera revue). On a
deux types groupes :
- Ceux qui vont effectuer une transmission directe, rapide, effet de type tout ou
rien (à gauche). On aura une ouverture et fermeture des canaux ioniques.
- Ceux qui vont provoquer des effets modulateurs un peu plus lents (à droite),
avec une action indirecte : ils vont réguler la transmission par l’intermédiaire de seconds messa-
gers. Ce sont par exemples de neuropeptides et des monoamines.
. Acides aminés à connaître :
Le glutamate est le principal neurotransmetteur excitateur au niveau de système nerveux cen-
tral. Il agit en dépolarisant les neurones et en augmentant la conductance membranaire en Na+.
Le GABA : acide gama amyno-butyrique qui est aa ; qui est le principal neurotransmetteur
inhibiteur. .Il agit en hyperpolarisant les neurones et en augmentant la conductance membra-
naire en Cl-.
La glycine est aussi un neurotransmetteur inhibiteur. Elle est principalement dans la moelle épi-
nière.
Les neuropeptides interviennent plus au niveau de la douleur, mais on ne va pas vraiment en parler.
Il faut savoir que la plupart des médicaments qu’on utilise pour le système nerveux central
peuvent provoquer des problèmes de dépendance.
sur 328

2. Exemple de neurotransmetteurs qui sont impliquées dans les pa-
thologies
Voici les principaux neurotransmetteurs impliqués dans les pathologies.
!
*L’acétylcholine qui est principalement impliqué dans la maladie Alzheimer.
*La dopamine est impliqué dans la maladie Parkinson, qui est impliqué dans le contrôle des mou-
vements, de la posture.
*Le GABA pour acide gamma-aminobutyrique qui est neurotransmetteur INHIBITEUR. Tous les
médicaments ou principe actif qui vont augmenter le niveau GABA, au niveau du système nerveux
central , (dans le cerveau) , sont toutes des molécules qui sont utilisées pour traiter les crises d’épi-
lepsies ou pour calmer les tremblements, dans la maladie Hungtingtone et aurait une action aussi
dans l’anxiété
*Le glutamate est une neurotransmetteur excitateur qui intervient aussi dans la maladie Alzheimer
mais dans la maladie Alzheimer c’est plus l’acétylcholine qui impliqué dans cette pathologie.
*La Noradrénaline joue un rôle dans la dépression. C’est NT important, dans tout ce qui concerne
les émotions, apprentissage, rêve , etc… , pour l’attention et dans les troubles de l’humeur égale-
ment.
*La sérotonine joue un rôle dans la dépression aussi.
La dépression implique la baisse de la plupart des neurotransmetteurs centraux.
sur 428

III-Acides aminés et pathologies impliqués
1. Epilepsie :
A. Définition & Généralités :
L’épilepsie est une décharge hyper synchrone des neurones de l’ensemble ou d’une partie limitée du
cortex.
Il y a différentes formes d’épilepsie :
-L’épilepsie généralisée (celle qu’on connaît le plus) est caractérisée par une crise tonico- clo-
nique de type grand mal durant plusieurs minutes. Elle possède 3 phases :
- une phase tonique caractérisée par morsure de la langue
- une phase clonique traduit par une alternance de contraction-décontraction des
muscles.
- une phase de résolution qui se traduit par un coma plus ou moins profond, avec perte d’urine
- L’absence de type petit mal qui dure quelques secondes (parfois on ne les remarque pas). Elle
apparaît brutalement et s’arrête aussi brutalement.
- L’épilepsie partielle qui n’atteint qu’une partie du cortex (elle n’est pas généralisée). La clinique
de cette maladie épileptique dépend de la zone corticale touchée (crises motrices, sensitives, audi-
tives, visuelles, comportementales).
- Il existe des formes rares et graves d’épilepsie, comme le syndrome d’épilepsie myoclonique ju-
vénile.
- La crise photosensible de type grand mal ou petit mal.
- La complication majeure correspond à l’état de mal épileptique où il y a un risque d’arrêt cardio-
respiratoire. Ce sont des états de crises qui se succèdent et qui ne s’arrêtent pas, sans retour à la
conscience. Là, il faut un traitement d’urgence : benzodiazépines en intraveineuse, diazépam, venti-
lation assistée, anti-épileptiques (acide valproïque qui est la dépakine en bolus puis en
perfusion ,gardenal en intraveiseuse lente, et si cela ne marche pas on peut rajouter de la phénytoine
en IV lente), contrôle ECG...
Concernant la physiopathlogie, plusieurs choses sont imbriquées :
- On a des phénomènes inter-neuronaux, qui correspondent à un défaut d’inhibition synaptique
GABA-ergique : le GABA est diminué. Il y a donc un défaut de l’action inhibitrice du GABA, et du
coup une augmentation de l’excitation synaptique.
On trouvera aussi une augmentation de l’excitabilité synaptique qui se traduit par une augmentation
de glutamate et d’aspartate.
sur 528
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
1
/
28
100%