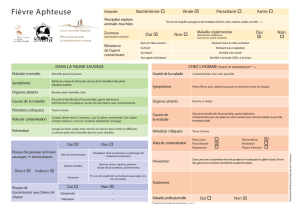
Risques de Cross-contamination

La société AKTEHOM, cabinet de conseil et d’expertise, accompagne les industriels de la pharmacie et des biotechnologies dans la
maîtrise de leurs procédés de fabrication et dans la compréhension du produit et du procédé dans un objectif de qualité et de
performance permettant de garantir la sécurité du patient. AKTEHOM s’oriente depuis sa création dans l’apport de valeur ajoutée à
ses clients pour leur permettre d’intégrer les évolutions techniques,règlementaires, scientifiques et humaines.
Découvrez nous : www.aktehom.com Contactez nous : aktehom@aktehom.com
Contexte
Démarche proposée
Bénéfices
Cross
contamination
Recherche des causes
(6M) Probabilité
Identification des
conséquences
Gravité
Evaluation du niveau
de risque
Probabilité x Gravité
Recherche des
moyens de mise sous
contrôle
Risque
résiduel Revue du
risque
Caractérisation du risque
Analyse du risque
D’après ICH Q9 – Quality Risk Management –2005
Initiation du processus de
Gestion du Risque Qualité
Identification du risque
Evaluation
du risque
Résultat du processus de
Gestion du Risque Qualité
Communication du risque
Outils de Gestion du Risque
Inacceptable
Réduction du risque
Acceptation du risque
Maîtrise
du risque
Revue des événements
Revue
du risque
R
Ri
is
sq
qu
ue
es
s
d
de
e
C
Cr
ro
os
ss
s-
-c
co
on
nt
ta
am
mi
in
na
at
ti
io
on
n
La Cross-contamination, source de non conformités des
produits pharmaceutiques, est essentielle à maîtriser
pour garantir la qualité des médicaments. Les entreprises
pharmaceutiques ont, d’une façon générale, mis en œuvre des
moyens permettant de prévenir ces risques par le non croisement
des différents flux. Cependant, compte tenu de la multiplicité des
sources de contamination ces actions ne sont pas suffisantes et,
les moyens à déployer ne sont pas toujours dimensionnés pour
sécuriser les opérations pharmaceutiques.
Le risque ne peut pas être écarté car les locaux, équipements et
utilités sont dans la plus part des cas mutualisés pour optimiser
les coûts d’investissement et de fonctionnement.
La réalisation d’un exercice
d’analyse de risques requiert
une méthodologie rigoureuse et des outils
adaptés. Il demande la participation active de
tous les acteurs de l’entreprise pour identifier
les risques et mises sous contrôle associées.
AKTEHOM peut aider ses clients dans la
création de matrices d’analyse et l’animation
des séances de travail.
Pour la prévention des cross-contamination, il
est nécessaire d’identifier les causes
potentielles de contamination, d’évaluer leur
impact sur la qualité attendue du produit
fabriqué et de définir des moyens de mise
sous contrôle ajustés au niveau de risque
déterminé.
Clé pour l’analyse, l’identification des causes
potentielles de contamination sera la plus
exhaustive possible.
Les origines de cross-
contamination seront
analysées selon les
6M. L’évaluation du
risque doit permettre
de prioriser les actions
de mise sous contrôle
qui seront déclinées
dans le plan d’action
issu de l’analyse.
Une analyse de Risques de contamination
croisée est menée selon une séquence
d’étapes consécutives.
Initiation du processus
Définition du Périmètre & des Référentiels
applicables
Recueil de la documentation associée à
l’activité analysée
Etablissement des matrices d’analyse et des
grilles de cotation
Séances de travail
Evaluation du risque
Identification des causes (6M) et impacts
suivant les plans de détail des bâtiments
Analyse : Probabilité de survenance et
gravité, détermination du niveau de risque
PxG
Caractérisation du risque par rapport à un
seuil « acceptable »
Identification des mises sous contrôle
Rédaction du rapport et communication
L’exhaustivité de l’analyse collégiale selon le
processus ICH Q9 permet de conforter le
design retenu ainsi que les pratiques
prévues. Les moyens de maîtrise identifiés,
dans ce cadre, pourront être priorisés de
façon à faire porter l’effort vers la prévention
du risque le plus élevé.
Quality Risk Management
Cross-contamination
1
/
1
100%