Le cancer du sein chez l homme

11
La Lettre du Sénologue - n° 17 - juillet/août/septembre 2002
e cancer du sein chez l’homme (CSH) est une affec-
tion rare qui représente dans les pays occidentaux de
0,5 à 1 % des cancers mammaires (2, 9, 11, 21, 25, 65,
68, 93) et de 0,4 à 1,2 % de tous les cancers masculins. La pre-
mière description remonte à 1307 et fut faite par un chirurgien
anglais, John of Arderne.
ÉPIDÉMIOLOGIE
Aux États-Unis, le CSH représente environ 0,7 % des cancers du
sein, soit environ 1 400 cas en 1999 (6, 22, 25, 65, 90). Le CSH
est rare au Japon, mais plus fréquent en Égypte (24, 25) ainsi que
dans certains pays asiatiques, et surtout en Afrique équatoriale
où il arrive à représenter jusqu’à 15 % de tous les cancers mam-
maires (1, 33, 59, 74). Dans les pays occidentaux, l’âge de sur-
venue se situe approximativement entre 60 et 65 ans (2, 9, 13, 14,
21, 25, 26, 34, 47, 48, 65, 68, 93), soit environ 8 à 10 ans plus
tard que chez la femme.
ÉTIOPATHOGÉNIE
Elle reste inconnue, étant donné la rareté de cette maladie (59,
65, 74). Pour de petits sous-groupes de patients, certains facteurs
de risque ont pu être mis en évidence (25) :
1) Le syndrome de Klinefelter, qui associe une trisomie XXY,
un hypogonadisme avec stérilité et une gynécomastie, comporte
un risque de 3 à 6 % de développement de carcinome mammaire
(10, 25, 27, 58, 65).
2) Les irradiations thoraciques dans l’enfance : dans une
revue de Kinne, 11 cas ont été rapportés (44, 52) ; il s’agissait de
nourrissons traités pour un thymome compressif et d’adolescents
porteurs de gynécomasties ou ayant eu des radioscopies répétées
pour tuberculose. Quelques cas survenus après irradiation pour
maladie de Hodgkin ont été également rapportés.
3) L’atrophie testiculaire, quelle qu’en soit l’origine (trauma-
tique, iatrogène, infectieuse), semble augmenter le risque (11,
16, 20, 30, 50). La cryptorchidie et la survenue des oreillons à
l’âge adulte constituent donc des facteurs de risque.
4) Les antécédents familiaux : il sont présents dans environ
6 à 10 % des cas (4, 5, 15, 16, 18, 29, 39, 45, 49, 51, 56, 57, 69,
71, 87) et parfois sous forme de cas multiples : plus récemment
des altérations géniques ont été notées chez certains patients (en
particulier au niveau de BRCA2 et du gène du récepteur aux
androgènes) (5, 25, 53, 84).
5) Certaines affections hépatiques entraînent une hyperproduc-
tion relative d’estrogènes (cirrhose, bilharziose)
Actuellement, des études sont en cours pour évaluer d’éventuels
facteurs de risque professionnel, comme l’exposition à la cha-
leur excessive (hauts fourneaux) et aux champs électromagné-
tiques (17, 29, 70, 81, 86). De même, des facteurs anthropo-
métriques, socioculturels, voire religieux ont été mis en évidence
(25, 50, 59, 74). Le cancer mammaire serait plus fréquent chez
les hommes de niveau culturel élevé, de poids et surtout de taille
élevés. Une fréquence accrue a également été retrouvée chez les
hommes d’origine juive et chez les sujets de race noire aux
États-Unis (16, 25, 56, 90).
En fait, l’hypothèse étiopathogénique de fond est celle d’un
déséquilibre entre androgènes et estrogènes, comme dans cer-
taines gynécomasties (7, 90).
Les mécanismes physiopathologiques conduisant à ce déséqui-
libre sont probablement multiples : augmentation des estrogènes
circulants (par production excessive, par diminution du catabo-
lisme ou augmentation de leur fraction libre), diminution des
androgènes circulants (par production insuffisante ou baisse de
leur fraction libre), modifications de l’équilibre testostérone/
estradiol, voire hyperprolactinémie (avec hypogonadisme induit
ou action directe sur le tissu mammaire).
Cependant, les rapports entre CSH et gynécomastie restent
incertains (11, 15, 21, 30, 32, 51), car la fréquence de cette der-
nière est différemment appréciée selon le type de population
analysée et les modalités de définition, cliniques ou histo-
logiques (30, 56).
De plus, les rares études où des bilans hormonaux ont été réali-
sés ne permettent aucune conclusion sur ce point.
Des hyperestrogénismes secondaires à une atteinte hépatique
(par bilharzie ou virus de l’hépatite B) pourraient expliquer la
fréquence élevée observée en Égypte (24) et dans les pays
d’Afrique équatoriale (74). Quelques cas de CSH après traite-
ment estrogénique prolongé pour cancer prostatique ou chez des
transsexuels ont été rapportés (23). Dans la cirrhose et l’insuffi-
sance rénale, on retrouve une hypoandrogénie et une fréquence
élevée de gynécomastie, voire de CSH pour certains. Une récente
étude cas-témoins franco-suisse (51) a mis en évidence, chez les
patients porteurs d’un CSH, une fréquence accrue de traitements
au long cours par digitaline et isoniazide. Ces drogues induisent,
par des mécanismes différents, une hyperestrogénie relative (7).
Le cancer du sein chez l’homme
●B. Cutuli*
* Polyclinique de Courlancy, Reims. E-mail : [email protected]
L

DOSSIER
12
La Lettre du Sénologue - n° 17 - juillet/août/septembre 2002
PARTICULARITÉS CLINIQUES ET MODALITÉS DU DIAGNOSTIC
La tuméfaction rétroaréolaire est de loin le principal symptôme
(11, 13, 14, 25, 26, 36, 38, 41, 43, 64, 65, 67, 75, 93). Les ano-
malies mamelonnaires (rétraction/ulcération) sont également fré-
quentes (11, 14, 72, 79, 82). Le délai entre les premiers symp-
tômes et le diagnostic est plus tardif que chez les femmes (25).
Un écoulement séro-sanglant est retrouvé dans 9 à 29 % des cas
(14, 25, 75, 90) et une maladie de Paget dans 1,4 à 8 % des cas
(14, 32, 37, 78). Ces deux modalités peuvent correspondre à un
cancer in situ, en particulier chez le sujet jeune (15, 40). Les
formes inflammatoires sont rares, représentant moins de 2 % des
cas (14, 25, 90).
La topographie rétroaréolaire et la faible épaisseur de tissu glan-
dulaire expliquent la fréquence élevée de formes avancées T4
(avec fixité au pectoral et/ou ulcération cutanée), surtout dans
les études anciennes (25, 90). Ce taux de T4 varie dans la litté-
rature de 19 à 25 % (14, 34, 35, 82, 83).
Des adénopathies axillaires palpables sont retrouvées dans
25 à 54 % des cas (11, 14, 21, 34, 35, 68). Aucun chiffre n’est
disponible concernant l’envahissement mammaire interne, mais,
en extrapolant les données chez la femme, on peut supposer qu’il
est particulièrement important compte tenu de la topographie
rétroaréolaire et de la fréquence de l’envahissement axillaire.
Des métastases initiales (surtout pulmonaires et/ou osseuses)
sont retrouvées dans 6 à 16 % des cas (14, 25, 75, 79, 87).
La bilatéralité (synchrone et/ou métachrone) semble moins fré-
quente que chez la femme. Crichlow rapporte un taux global de
1,4 % (11).
L’examen clinique évoque le diagnostic et permet la stadification
de la tumeur selon la classification TNM. La mammographie
permet en règle générale de différencier une tumeur d’une gynéco-
mastie, voire d’une simple adipomastie. La tumeur correspond
le plus souvent à une opacité dense, plus ou moins ronde ou spi-
culée, avec parfois épaississement ou rétraction cutanée et/ou
présence de microcalcifications (19, 28, 61). L’échographie peut
apporter un complément d’information, surtout en cas de lésions
arrondies ou polylobées évoquant une gynécomastie (25).
La ponction cytologique à l’aiguille permet souvent une confir-
mation de la malignité sans cependant toujours pouvoir identifier
le type précis de lésion. Il en est de même de la cytologie réalisée
à partir d’un écoulement. Le diagnostic histologique définitif peut
se faire par ponction-biopsie ou microbiopsie. Toutefois, il est établi
le plus souvent lors de l’acte chirurgical par un examen extem-
porané suivi d’un examen définitif sur coupes en paraffine.
La stadification repose toujours sur la classification TNM,
comme chez la femme. Le bilan d’extension comprend les
mêmes examens (cliché thoracique, échographie hépatique, scin-
tigraphie osseuse et dosage du CA 15-3). Globalement, les CSH
sont de stade plus avancé que chez la femme.
CARACTÉRISTIQUES HISTOLOGIQUES
Le type histologique le plus fréquent (environ 85 %) est le car-
cinome canalaire infiltrant (5, 11, 14, 21, 25, 34, 65, 68, 72, 89,
93) avec parfois une composante canalaire in situ en périphérie
(25, 38). Les carcinomes canalaires in situ (CCIS) purs sont rares
(8, 15, 40), représentant environ 7 % des cas en moyenne dans
les séries de CSH (de 0 à 17 %). Il s’agit surtout de formes papil-
laires (pures ou intrakystiques) (15) ou cribriformes, alors que
le comédocarcinome est beaucoup moins fréquent que chez la
femme. Des formes rares (colloïde, médullaire, papillaire, tubu-
laire) sont également retrouvées (14, 82) (tableau I). En
revanche, les carcinomes lobulaires sont exceptionnels ; ils ont
été rapportés chez des patients porteurs d’une gynécomastie ou
d’un syndrome de Klinefelter, ou sans autres précisions (72, 73,
89). La maladie de Paget isolée, confirmée histologiquement, est
également rare (37). Parmi les formes non épithéliales, les sar-
comes et les lymphomes sont exceptionnels (89, 90). Le taux
d’envahissement ganglionnaire axillaire (pN+) varie de 30 à
71 % selon le diamètre tumoral clinique (14, 25, 34, 35, 42).
Heller (38) rapporte 35 et 75 % de pN+ respectivement pour les
tumeurs de moins et de plus de 2 cm. Il reste de loin, comme
chez la femme, le premier facteur pronostique.
Pour Salvadori (72), il y a 25 % de pN+ parmi les T1 et 60 %
parmi les T4. Dans une étude multicentrique française (14),
parmi 308 patients ayant eu un curage axillaire, le taux global de
pN+ est de 56 % et respectivement de 38, 55 et 62 % pour les
groupes T0T1, T2 et T3T4. Toujours pour cette étude, dans
31,6 % des cas pN+, un seul ganglion était atteint ; dans 20,1 %,
deux ou trois, et dans 48,3 %, quatre ou plus. Les récepteurs hor-
monaux aux estrogènes et à la progestérone (RE, RP) sont plus
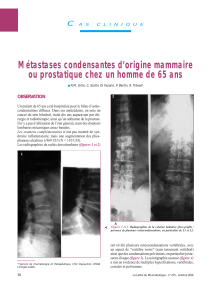
Figure. Mammographie d’un homme de 68 ans. Opacité irrégulière. La
masse rétractait la peau cliniquement. Histologie : cancer canalaire
infiltrant.
Carcinome canalaire invasif 92 %
Carcinome colloïde (mucineux) 1%
Carcinome médullaire 4%
CCIS 3%
Tableau I. Sous-types histologiques des CSH retrouvés dans 4 séries
de la littérature (modifiés d’après Fentiman [30]).

13
La Lettre du Sénologue - n° 17 - juillet/août/septembre 2002
souvent positifs que chez la femme (environ 70 à 80 % des cas)
et fréquemment à des taux beaucoup plus élevés (14, 25, 31, 44,
72, 80). La répartition selon la classification histopronostique
SBR est superposable à celle de la femme, avec une majorité de
grades II et un taux similaire de grades I et III (14, 42, 62, 76,
89) (tableau II).
TRAITEMENT
Le traitement est avant tout chirurgical (5, 9, 11, 25, 72, 77). La
mastectomie radicale (Halsted) a été progressivement remplacée
par la mastectomie radicale modifiée (Patey-Madden), dont
l’efficacité est comparable et qui entraîne un taux inférieur de
lymphœdème. De plus, la conservation des pectoraux permet un
résultat esthétique et fonctionnel correct. En cas d’atteinte pro-
fonde, une résection musculaire partielle peut cependant être
nécessaire. La mastectomie simple n’est à réserver qu’aux
formes in situ pures de taille inférieure à 3 cm (8, 15) (au-delà,
la recherche du ganglion sentinelle et/ou une exploration de
l’étage inférieur de l’aisselle sont conseillées compte tenu du pos-
sible risque de micro-invasion occulte). La tumorectomie simple
est suivie d’un risque élevé de récidive et ne peut se concevoir
qu’associée à une irradiation complémentaire, chez des patients
présentant des contre-indications anesthésiques majeures (14).
L’irradiation locorégionale (paroi thoracique, relais mammaires
internes, sus- et sous-claviculaires élargis) améliore le contrôle
local (14, 25, 83) ; les indications en sont larges compte tenu de
la présence très fréquente de facteurs de risque de récidive loco-
régionale (pN+, atteinte cutanée et/ou musculaire) et des marges
de sécurité souvent réduites en raison de la faible épaisseur glan-
dulaire. Avec un repérage scanographique préalable et une dosi-
métrie prévisionnelle avec utilisation des électrons d’accéléra-
teur linéaire, on peut délivrer des doses tumoricides (50 Gy
environ en fractionnement classique) sans provoquer d’effets
secondaires au médiastin ni à l’aire cardiaque sous-jacente. Cela
est d’autant plus important qu’il s’agit souvent de patients âgés,
ayant des pathologies cardiaques et/ou pulmonaires associées.
Compte tenu de la rareté de l’affection, l’apport des traitements
médicaux adjuvants reste difficile à évaluer (3, 14, 34, 63, 66,
77, 88). Deux études (3, 63), incluant un faible nombre de
patients sélectionnés, ont mis en évidence un bénéfice de la
chimiothérapie. Toutefois, compte tenu de l’âge avancé, de la
présence d’affections chroniques associées et de la très grande
fréquence de la positivité des récepteurs hormonaux (RH), le
tamoxifène est plutôt le traitement de référence (25, 88, 90), bien
que ce produit puisse entraîner des effets secondaires (diminution
de la libido, bouffées de chaleur, prise de poids, accidents throm-
boemboliques, dépression) qui conduisent à son arrêt dans 25 %
des cas (25). Par analogie avec la femme, la chimiothérapie adju-
vante (de type CMF ou à base d’antracyclines) est indiquée chez
les patients jeunes avec envahissement ganglionnaire ou éven-
tuellement avec des lésions de grade SBR III et RH–. Bien
entendu, aucune étude randomisée n’a pu être réalisée pour éva-
luer précisément les bénéfices de ces traitements.
En phase métastatique, de multiples schémas d’hormonothérapie
(ablative, additive ou compétitive) et/ou de chimiothérapie (25,
46, 54, 55, 85, 90, 92) ont été utilisés, avec des résultats très dif-
ficiles à évaluer. Dans cette situation, c’est encore le tamoxifène
qui est le plus souvent utilisé en première ligne (25, 54, 65, 66,
85). L’efficacité du tamoxifène est comparable à celle de la pul-
pectomie, mais avec une acceptabilité et une tolérance supé-
rieures. Les réponses seraient dépendantes du taux de récepteurs
aux estrogènes de la tumeur (85).
Aucune donnée précise n’est encore disponible avec les anti-
aromatases.
FACTEURS PRONOSTIQUES
Comme chez la femme, l’envahissement ganglionnaire histo-
logique axillaire et la taille clinique restent les principaux fac-
teurs de pronostic (11, 14, 25, 34, 35) (tableau III). Chez
l’homme, l’incidence des seconds cancers (prostate et côlon sur-
tout) est particulièrement élevée (plus de 10 %) (12, 60, 74), de
même que le nombre de pathologies intercurrentes sévères
(cardiovasculaires et respiratoires surtout). Les taux de décès
sont donc très différents selon les modalités d’analyse, et il faut
plutôt raisonner en termes de survie spécifique corrigée (ne
comptabilisant que le décès par cancer mammaire) que de survie
globale (30, 42, 91).
Dans l’étude multicentrique française, les taux de survie globale
à 5 et 10 ans sont respectivement de 65 et 38 %, alors que les
mêmes taux, en survie spécifique corrigée, atteignent 74 et 51 %
(14). Ces différences sont retrouvées par d’autres auteurs (65,
67, 68, 76, 77).
T (cm) N pN (%) S5 (%)
≤1233094
1,1-2 87 39 80
2,1-3 55 53 78
3,1-4 38 45 81
4,1-5 26 65 41
> 5 28 7139
Tableau III. Corrélation entre la taille clinique (T), l’envahissement
histologique axillaire (pN) et la survie à 5 ans (modifié d’après Guinee
[35]).
Grade
123
Cutuli (14) 44 (20 %) 129 (58 %) 50 (22 %)
Stierer (82) 11 (11 %) 53 (56 %) 31 (33 %)
Visfeldt (89) 44 (29 %) 81 (54 %) 25 (17 %)
Total 99 (21 %) 263 (56 %) 106 (23 %)
Tableau II. Répartitions des lésions selon le grade histopronostique
SBR.

DOSSIER
14
La Lettre du Sénologue - n° 17 - juillet/août/septembre 2002
Les tableaux IV et V détaillent les chiffres en rapport avec les
divers facteurs de risque (T et pN) selon les deux modes de cal-
cul. Il apparaît que, pour les groupes T0T1 et T2, les survies spé-
cifiques à 10 ans sont de 88 et 73 %, tout à fait comparables aux
taux retrouvés dans des études réalisées chez la femme, quel que
soit le type de traitement (radical ou conservateur) et qui varient
de 71 à 80 % (14, 77, 91). De même, à la suite d’une analyse
multifactorielle (modèle de Cox), il est possible de quantifier le
risque relatif de décès en fonction des différents sous-groupes :
il passe de 1 pour les T0T1pN– à 6 pour les T3T4 pN+ (14).
Globalement, on peut considérer que le pronostic du CSH, à
stade égal et en ne comptabilisant que les décès par cancer mam-
maire, est comparable à celui de la femme. La notion de pro-
nostic plus défavorable (42, 65, 91) repose sur l’analyse de séries
anciennes, qui comprenaient de très nombreuses formes avan-
cées de diagnostic tardif et dont le traitement avait été presque
uniquement chirurgical (11, 36, 64, 67, 79).■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Ajayi DOS, Osegbe DN, Ademiluyi SA. Carcinoma of the male breast in West
Africans and a review of world literature. Cancer 1982 ; 50 : 1664-7.
2. Axelsson J, Andersson A. Cancer of the male breast. World J Surg 1983 ; 7 :
281-7.
3. Bagley CS, Wesley MN, Young RC, Lippman ME. Adjuvant chemotherapy in
males with cancer of the breast. Am J Clin Oncol 1987 ; 10 : 55-60.
4. Bascham VM, Lipscome JM, Ward JM et al. BRCA 1 and BRCA 2 mutations
in a population-based study of male breast cancer. Breast Cancer Res 2002 ; 4.
5. Borgen PI, Wong GY, Vlamis V et al. Current management of Male Breast
Cancer. A review of 104 cases. Ann Surg 1992 ; 215 : 451-9.
6. Borgen PI, Senie RT, McKinnon WM, Rosen PP. Carcinoma of the male
breast : analysis of prognosis compared with matched female patients. Ann Surg
Oncol 1997 ; 4 : 385-8.
7. Braunstein GD. Gynecomastia. N Engl J Med 1993 ; 328 : 490-5.
8. Camus MF, Joshi MG, Mackarem G et al. Ductal Carcinoma in situ of the
male breast. Cancer 1994 ; 74 : 1289-93.
9. Carlsson G, Hafstrom L, Jonsson PE. Male breast cancer. Clin Oncol 1981 ;
7: 149-55.
10. Coley GM, Otis RD, Clark WE. Multiple primary tumors including bilateral
breast cancers in a man with Klinefelter’s syndrome. Cancer 1971 ; 27 : 1476-81.
11. Crichlow RW, Galt SW. Male breast cancer. Surgical Clinics of North Ame-
rica 1990 ; 70 (5) : 1165-77.
12. Cutuli B, Lacroze M, Dilhuydy JM et al. Cancer du sein chez l’homme : fré-
quence et types des cancers associés : antérieurs, synchrones et métachrones.
Bull Cancer 1992 ; 79 : 689-96.
13. Cutuli B, Velten M, Florentz P et al. Cancer du sein chez l’homme : 106
observations. Presse Med 1993 ; 22 : 463-6.
14. Cutuli B, Lacroze M, Dilhuydy JM et al. Male breast cancer. Results of the
treatments and prognostic factors in 397 cases. Eur J Cancer 1995 ; 31A :
1960-4.
15. Cutuli B, Dilhuydy JM, de la Fontan B. Ductal carcinoma in situ of the
male breast : analysis of 31 cases. Eur J Cancer 1997 ; 33: 35-8.
16. D’Avanzo B, la Vecchia C. Risk factors for male breast cancer. Br J Cancer
1995 ; 71 : 1359-62.
17. Demers PA, Thomas DB, Rosenblatt KA et al. Occupational exposure to
electromagnetic fields and breast cancer in men. Am J Epid 1991 ; 4 : 340-7.
18. Demeter JG, Waserman NG, Verdi GD. Familial Male Breast Carcinoma.
Cancer 1990 ; 65 : 2242-3.
19. Dershaw DD. Male mammography. AJR 1986 ; 146 : 127-31.
20. Donegan WL. Cancer of Breast in Men. Ca 1991 ; 6 : 339-54.
21. Donegan WL, Redlich PN. Breast cancer in men. Surg Clin North Am
1996 ; 76 : 343-63.
22. Donegan WL, Redlich PN, Lang PJ, Gall MT. Carcinoma of the breast in
males : a multi institutional survey. Cancer 1998 ; 83: 498-509.
23. Dore B, Dombriz M, Denis P et al. Cancer du sein chez les malades por-
teurs d’un cancer prostatique traité par les estrogènes : À propos de 3 observa-
tions. J Urol 1982 ; 88 (4) : 247-52.
24. El-Gazayerli MM, Abdel-Aziz AS. On Bilharziosis and male breast cancer
in Egypt : a preliminary report and review of the literature. Br J Cancer 1963 ;
17 : 566-71.
25. English JC, Middleton C, Patterson JW, Slingluff CL. Cancer of the male
breast. Int J Dermatol 2000 ; 39 : 881-9.
26. Erlichman C, Murphy KC, Elhakim T. Male breast cancer : a 13 year
review of 89 patients. J Clin Oncol 1984 ; 2 : 903-9.
27. Evans DB, Crichlow RW. Carcinoma of the male breast and Klinefelter’s
syndrome : Is there an association ? CA 1987; 37 : 246-51.
28. Evans GF, Anthony T, Appelbaum AH et al. The diagnostic accuracy of
mammography in the evaluation of male breast disease. Arm J Surg 2001 ; 181 :
96-100.
29. Ewertz M, Holmberg L, Tretli S et al. Risk factors for male breast cancer. A
case control study from Scandinavia. Acta Oncol 2001 ; 40: 467-71.
30. Fentiman IS. Male breast cancer : In Fentiman I.S. ed. : Detection and
Treatment of early breast cancer London. Martin Dunitz 1990 ; 207-18.
31. Friedman MA, Hoffman PG, Dandolos EM et al. Estrogen receptors in male
breast cancer : clinical and pathologic correlations. Cancer 1981 ; 47: 134-7
32. Gadenne C, Contesso G, Travagli JP et al. Tumeurs du sein chez l’homme.
Étude anatomo-clinique. 73 observations. Nouv Presse Méd 1982 ; 11 : 2331-4.
33. Gombe-Mbalawa C, Paraiso DI, Galiba EP. Fréquence relative des can-
cers du sein chez l’homme à Brazzaville. Bull Cancer 1989 ; 76 : 1039-40.
34. Goss PE, Reid C, Pintilie M et al. Male breast carcinoma. A review of
229 patients who presented to the Princess Margaret Hospital during 40 years :
1955-1996. Cancer 1999 ; 85 : 629-39.
SG SS
5 ans 10 ans 5 ans 10 ans
T0T1 85 % 65 % 88 % 74 %
T2 63 % 37 % 73 % 48 %
T3T4 51 % 18 % 65 % 34 %
Tableau IV. Taux de survie globale (SG) et survie spécifique (SS)
(avec exclusion des décès par second cancer et maladie intercurrente)
dans l’étude multicentrique française (14), en fonction de la taille cli-
nique (T).
Survie globale
5 ans 5 ans 10 ans 10 ans
Cutuli (1) Guinee (2) Cutuli (1) Guinee (2)
pN0 82 % NP 50 % 84 %
pN1-3 62 % NP 37 % 44 %
pN > 3 60 % NP 19 % 14 %
Tableau V. Survie globale (SG) et survie spécifique (SS) (avec exclu-
sion des décès par second cancer et maladie intercurrente) dans deux
études multicentriques (14, 35) en fonction du statut ganglionnaire
axillaire histologique (pN).
Survie spécifique
5 ans 5 ans 10 ans 10 ans
Cutuli (1) Guinee (2) Cutuli (1) Guinee (2)
pN0 93 % 90 % 77 % 84 %
pN1-3 70 % 73 % 50 % 44 %
pN > 3 64 % 69 % 39 % 14 %

15
La Lettre du Sénologue - n° 17 - juillet/août/septembre 2002
35. Guinee VF, Olsson H, Moller T et al. The prognosis of breast cancer in
males. A report of 335 cases. Cancer 1993 ; 71 : 154-61.
36. Gupta S, Pant GC, Gupta S. Male breast cancer. J Surg Oncol 1981 ; 16 :
149-57.
37. Gupta S, Khanna NN, Khanna S, Gupta S. Paget’s disease of the male
breast : a clinicopathologic study and a collective review. J Surg Oncol 1983 ;
22 : 151-6.
38. Heller KS, Rosen PP, Schottenfeld D et al. Male breast cancer : a clinico-
pathologic study of 97 cases. Ann Surg 1978 ; 188 : 60-5.
39. Hill A, Yagmour Y, Tran KN et al. Localized male breast carcinoma and
family history. An analysis of 142 patients. Cancer 1999 ; 86 : 821-5.
40. Hittmair AP, Lininger RA, Tavassoli FA. Ductal carcinoma in situ (DCIS)
in the male breast. A morphologic study of 84 cases of pure DCIS and 30 cases
of DCIS associated with invasive carcinoma. A preliminary report. Cancer 1998 ;
83 : 2139-49.
41. Hodson GR, Urdaneta LF, Al-Jurf AS, Jochimsen PR. Male breast carci-
noma. Am Surg 1985 ; 51 : 47-9.
42. Joshi MG, Lee AKC, Loda M et al. Male breast carcinoma : an evaluation
of prognostic factors contributing to a poorer outcome. Cancer 1996 ; 77 : 490-8.
43. Kapdi CC, Parekh NJ. The male breast. Rad Clin North Am 1983 ; 21 :
137-48.
44. Kinne DW. Male Breast Cancer. In : Harris J.R., Hellmann S., Henderson
I.C., Kinne D. eds. Breast Diseases Lippincott. Philadelphia 1987 ; 577-83.
45. Kozak FK, Hall JG, Baird PA. Familial breast cancer in males. A case
report and Review of the Literature. Cancer 1986 ; 58 : 2736-9.
46. Kraybill WG, Kaufman R, Kinne D. Treatment of advanced male breast
cancer. Cancer 1981 ; 47 : 2185-9.
47. Izquierdo MA, Alonso C, De Andres L et al. Male breast cancer. Report of
a series of 50 cases. Acta Oncol 1994 ; 33 : 767-71.
48. Langlands AO, MacLean N, Kerr GR. Carcinoma of the male breast :
report of a series of 88 cases. Clin Radiol 1976 ; 27 : 21-5.
49. Laraja RD, Pagnozzi JA, Rothenberg RE et al. Carcinoma of the Breast in
three sibling. Cancer 1985 ; 55 : 2709-11.
50. La Vecchia C, Levi F, Lucchini F. Descriptive epidemiology of male breast
cancer in Europe. Int J Cancer 1992 ; 51 : 62-6.
51. L’Enfant-Pejovic MH, Cabanne NM, Bouchardy C, Auquier A. Risk factors
for male breast cancer : a franco-swiss case-control study. Int J Cancer 1990 ;
45 : 661-5.
52. Li FP, Corkery J, Vawter G, Fine W, Sallan SE. Breast carcinoma after
cancer therapy in childhood. Cancer 1983 ; 51 : 521-3.
53. Loboccaro JM, Lumbroso S, Belon S et al. Androgen receptor gene muta-
tion in male breast cancer. Hum Molec Genetics 1993 ; 2 : 1799-802.
54. Lopez M, Di Lauro L, Lazzaro B, Papaldo P. Hormonal treatment of disse-
minated male breast cancer. Oncology 1985 ; 42 : 345-9.
55. Lopez M, Di Lauro L, Papaldo P, Lazzaro B. Chemotherapy in metastatic
male breast cancer. Oncology 1985 ; 42 : 205-9.
56. Mabuchi K, Bross DS, Kessler II. Risk factors for male breast cancer.
J.N.C.I. 1985 ; 74 : 371-5.
57. Marger D, Urdaneta N, Fischer JJ. Breast cancer in brothers. Case reports
and a review of 30 cases of male breast cancer. Cancer 1975 ; 36 : 458-61.
58. Moshakis V, Fordyce MJ, Griffiths JD. Klinefelter’s syndrome associated
with breast carcinoma and Pagets’s disease of the nipple. Clinical Oncology
1983 ; 9 : 257-61.
59. Nectoux J, Parkin DM. L’épidémiologie du cancer du sein chez l’homme.
Bull Cancer 1992 ; 79 : 991-8.
60. Neugut AI, Murray TI, Lee WC, Robinson E. The association of breast can-
cer and colorectal cancer in men. An analysis of surveillance, epidemiology and
end results program data. Cancer 1991 ; 68 : 2063-73.
61. Ouimet-Oliva D, Hebert G, Ladouceur J. Radiographic characteristics of
male breast cancer. Radiology 1978 ; 129 : 37-40.
62. Ouriel K, Lotze MT, Hinshaw JR. Prognostic factors of carcinoma of the
male breast. Surg Gynecol Obstet 1984 ; 159 : 373-6.
63. Patel HZ, Buzdar AV, Hortobagy GN. Role of adjuvant chemotherapy in
male breast cancer. Cancer 1989 ; 64 : 1583-5.
64. Ramantanis G, Besbeas S, Garas JG. Breast cancer in the male : a report of
138 cases. World J Surg 1980 ; 4 : 621-4.
65. Ravandi-Kashani F, Hayes TG. Male breast cancer : a review of the litera-
ture. Eur J Cancer 1998 ; 34 : 1341-7.
66. Ribeiro GG. Tamoxifen in the treatment of male breast carcinoma. Clin
Radiol 1983 ; 34 : 625-8.
67. Ribeiro GG. Male breast carcinoma. A review of 301 cases from the Christie
Hospital and Holt Radium Institute, Manchester. Br J Cancer 1985 ; 51 : 115-9.
68. Ribeiro GG, Swindell R, Harris M et al. A review of the management of the
male breast carcinoma based on an analysis of 420 treated cases. The Breast
1996 ; 5 : 141-6.
69. Rosenblatt KA, Thomas DB, Stemhagen A et al. Familial risk factors for
male breast cancer. Amer J Epidemiol 1989 ; 130 : 812.
70. Rosenblatt KA, Thomas DB, Jimenez IM et al. Exposure to ionizing radia-
tion and breast cancer in men. Amer J Epidemiol 1990 ; 132 : 776.
71. Rosenblatt KA, Thomas DB, Mc Tiernan A et al. Breast cancer in men :
aspects of familial agregation. J Nat Cancer Inst 1991 ; 12 : 849-54.
72. Salvadori B, Saccozzi R, Manzari A et al. Prognosis of breast cancer in
males : an analysis of 170 cases. Eur J Cancer 1994 ; 30A: 930-5.
73. Sanchez AG, Villanueva AG, Redondo C. Lobular carcinoma of the breast
in a patient with Klinefelter’s syndrome. Cancer 1986 ; 57 : 1181-3.
74. Sasco AJ, Lowenfels AB, Pasker-De Jong P. Review article : epidemiology
of male breast cancer. A meta-analysis of published case-control studies and
discussion of selected aetiological factors. Int J Cancer 1993 ; 53 : 538-49.
75. Scheike O. Male breast cancer. 5. Clinical manifestations in 257 cases in
Denmark. Br J Cancer 1973 ; 28 : 552-61.
76. Scheike O. Male breast cancer. 6. Factors influencing prognosis. Br J Can-
cer 1974 ; 30 : 261-71.
77. Scott-Conner CE, Jochimsen PR, Menck HR, Winchester DJ. An analysis of
male and female breast cancer treatment and survival among demographically
identical pairs of patients. Surgery 1999 ; 126 : 775-80.
78. Serour F, Birkenfeld S, Amsterdam E et al. Paget’s disease of the male
breast. Cancer 1988 ; 62 : 601-5.
79. Spence RAJ, Mackenzie G, Anderson JR et al. Long-term survival following
cancer of the male breast in Northern Ireland. A report of 81 cases. Cancer
1985 ; 55 : 648-51.
80. Stalsberg H, Thomas DB, Rosenblatt KA et al. Histologic types and hor-
mone receptors in breast cancer in United States men : a population-based
study in 282 men. Cancer causes and control 1993 ; 4 : 143-51.
81. Stevens RG, Davis S, Thomas DB et al. Electric power, pineal function, and
the risk of breast cancer. FASEB Journal 1992 ; 6 : 853-60.
82. Stierer M, Rosen H, Weitensfelder W et al. Male breast cancer : Austrian
experience. World J Surg 1995 ; 19 : 687-93.
83. Stranzl H, Mayer R, Quehenberger F et al. Adjuvant radiotherapy in male
breast cancer. Radiother Oncol 1999 ; 53 : 29-35.
84. Thorlacius S, Tryggvadottir L, Olafsdottir GH et al. Linkage to BRCA 2
region in hereditary male breast cancer. Lancet 1995 ; 346 : 544-5.
85. Tirelli U, Tumolo S, Talamini R, Veronesi A et al. Tamoxifen before and after
orchiectomy in advanced male breast cancer. Cancer Treat Rep 1982; 66: 1882-3.
86. Tynes T, Andersen A. Electromagnetic fields and male breast cancer. Lancet
1990 ; 336 : 1596 (letter).
87. Van Geel AN, Slooten EA, Mavrunac M, Hart AAM. A retrospective study
of male breast cancer in Holland. Br J Surg 1985 ; 72 : 724-7.
88. Vinod SK, Pendlebury SC. Carcinoma of the male breast : a review of adju-
vant therapy. Australas Radiol 1999 ; 43 : 69-72.
89. Visfeldt J, Scheike O. Male breast cancer. I. Histologic typing and grading
of 187 danish cases. Cancer 1973 ; 22 : 985-90.
90. Wilhelm MC, Wanebo HJ. Cancer of the male breast In Bland K.I. Cope-
land E.M. eds. : The Breast comprehensive management of benign and mali-
gnant diseases. Philadelphia/W.B. Saunders Co 1991 ; 1030-3.
91. Willsher PC, Leach IH, Ellis IO et al. A comparizon outcome of male breast
cancer with female breast cancer. Arm J Surg 1997 ; 173 : 185-8.
92. Yap HY, Tashima CK, Blumenschein GR et al. Chemotherapy for advanced
male breast cancer. Jama 1980 ; 243 (17) : 1739-41.
93. Yildirim E, Berberoglu U. Male breast cancer : a 22-year experience. Eur J
Surg Oncol 1998 ; 24 : 548-52.
1
/
5
100%