DEVOIR MAISON N°3

DEVOIR MAISON N°3
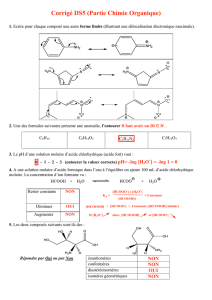
Exercice I : Structure d'une molécule d'herbicide
Le chlorbufame est un herbicide utilisé pour le désherbage des plantes à bulbes et
pour empêcher la germination des pommes de terre lors de leur conservation. Le
modèle moléculaire est donné dans le document ci-contre.
1. Cette molécule présente deux chaînes carbonées réunies par le groupe :
Dessiner ces deux chaînes et attribuer à chacune d'elles les qualificatifs qui lui
conviennent : saturée, insaturée, cyclique, linéaire, ramifiée.
2. Déterminer la formule brute du chlorbufame ; en déduire sa masse molaire.
3. a. Écrire la formule électronique de tous les atomes présents dans la molécule.
3. b. Vérifier que tous ces atomes respectent la règle de l'octet ou du duet.
4. a. Rappeler la définition de : carbone tétragonal, carbone trigonal, carbone digonal.
4.b. La molécule de chlorbufame présente-t-elle ces trois types d'atomes de carbone ? Si oui, les repérer sur la
formule.
5. Cet herbicide peut être utilisé à raison de 50,0 g pour 100 litres d'eau.
5.a. Calculer la concentration massique correspondante.
5.b. En déduire la concentration molaire de la solution.
5.c Déterminer la quantité d'eau, puis celle de chlorbufame contenus dans 1,00 L de solution ; en déduire la teneur
de la solution en chlorbufame exprimée en p.p.m. sachant qu'ici, le nombre de p.p.m représente la quantité de
chlorbufame, exprimée en micromoles, présent par mole d'eau dans la solution.
Données
Masses molaires en g.mol-1 et couleurs des atomes dans le modèle moléculaire:
H : 1,0 (blanc) ; C : 12,0 (noir) ; N : 14,0 (bleu) ; O : 16 (rouge) ; Cl : 35,5 (vert).
Exercice II Isomérie Z-E et reproduction
La communication entre les insectes de même espèce se fait essentiellement à l'aide de molécules chimiques
nommées phéromones. En période de reproduction, la femelle du papillon du ver à soie (bombyx mori), incapable de
voler, libère dans l'atmosphère 4.10-8 g d'une substance nommée bombykol, ce qui lui permet de signaler sa présence
à tout mâle présent dans un rayon de 50 m.
La représentation semi-développée plane du bombykol est la suivante:
HO - (CH2)9 - CH = CH - CH = CH - (CH2)2 - CH3
a b
La configuration des deux doubles liaisons carbone-carbone est fondamentale; Le mâle n'étant sensible qu'à un
isomère particulier. Le tableau suivant présente l'activité biologique des différents isomères.
Isomères Activité biologique* en microgramme
par litre d'air
a Z, b Z 1
a Z , b E 10-2
A E , bZ 10-12
A E , b E 102
Bombykol sécrété par la femelle 10-10
*Définition de l'activité biologique: quantité minimale de composé à vaporiser pour déclencher une réponse positive
sur un échantillon déterminé d'individus.
JL MARTIN v 4/06 DM 3.sxw cours 1ere S
rouge
bleu vert

1. Écrire les formules semi-développées des différents isomères possibles du fait de la présence des deux doubles
liaisons carbone-carbone.
2. Quel est, selon le tableau, l'isomère le plus efficace ?
3. De quel isomère le bombykol naturel est-il formé ?
4. Comment peut-on expliquer que l'activité biologique du bombykol naturel soit plus faible que celle de l'isomère
pur ?
5. Déterminer la quantité, en mole, de bombykol émis par la femelle et le nombre d'entités élémentaires
correspondant.
6. En admettant que le bombykol soit libéré par la femelle de manière homogène dans un volume sphérique de 50 m
de rayon, déterminer le nombre d'entités élémentaires présentes par mètre cube d'air.
7. Cette phéromone peut être détectée par le bombyx à la dose de deux cents d'entités élémentaires par
centimètre cube d'air.
Conclusion.
La répartition homogène du bombykol dans l'espace permet elle au mâle de retrouver la femelle?
Quel modèle pourrait-on proposer ?
Exercice III Quel est ce polymère?
La masse molaire moyenne d'un polymère P est de 125 000 g.mol-1 de degré de polymérisation n = 2000.
Sa composition centésimale massique est: %(CL) = 56,8; %(C) = 38,4; le reste étant de l'hydrogène.
1. Déterminer la masse molaire moléculaire du monomère correspondant ainsi que sa formule brute.
2. a. Donner sa formule semi-développée, sa formule topologique et son nom.
b. En déduire le nom du polymère étudié.
3. La combustion complète de P conduit à l'obtention de trois produits: le dioxyde de carbone, l'eau et le chlorure
d'hydrogène.
a. Écrire l'équation de la réaction de combustion réalisée avec un excès de dioxygène.
b. Lequel des trois produits est le plus toxique ?
Exercice IV La banane ou la poire ?
L'acétate d'isoamyle de formule topologique:
est un ester dont l'odeur est celle de la banane ou de la poire. On peut réaliser La synthèse de cet ester au
laboratoire par action de l'acide acétique CH3-C00H sur l'alcool isoamylique
Cette réaction est une estérification.
1. Écrire la formule développée de l'acide acétique.
2. Écrire l'équation de la réaction d'estérification, sachant qu'il se forme aussi une petite molécule.
3. Quelles masses minimales d'acide acétique et d'alcool isoamylique faut-il utiliser pour obtenir v = 10 mL d'ester,
sachant que la masse volumique de l'ester est µ=870 g.L-1
JL MARTIN v 4/06 DM 3.sxw cours 1ere S
O
O
OH
1
/
2
100%