D.S.T. N° 6

CLASSE DE TERMINALE S
Le : 25 mai 2011
Durée : 2 h 00
Physique-Chimie
DEVOIR SUR TABLE N° 6
TOUT DOCUMENT INTERDIT.
L’usage de calculatrices scientifiques à mémoire est autorisé.
Les résultats numériques doivent être précédés d’un calcul littéral.
La présentation et la rédaction font partie du sujet et interviennent dans la notation.
L’épreuve est notée sur 16 points auxquels s’ajouteront les points d’épreuve pratique sur 4 points.
I ] CHIMIE : sur 8 points.
LE SAVON D’ALEP
LE SAVON D’ALEPLE SAVON D’ALEP
LE SAVON D’ALEP
1. Étude de la fabrication d’un savon.
Lire attentivement le texte suivant avant de répondre aux questions posées.
« Les premiers savons dits « durs » ont été élaborés dans le Nord de l’actuelle Syrie au VIIIe siècle. Un savon est
« mou » si l'on utilise de la potasse, « dur » si on emploie de la soude. Le savon d’Alep est obtenu par traitement à chaud
d'huile d’olive par l’hydroxyde de sodium. Le processus chimique qui aboutit au savon peut se formuler ainsi :
huile d’olive + soude
→
savon + glycérol.
Fabrication « en chaudron » du savon d’Alep.
La technique, pratiquée à l’ancienne, dure plus d’une semaine et comprend les quatre phases suivantes.
L’empâtage : il consiste à mettre en présence l’huile d’olive et la soude caustique dans des proportions
données (de telle manière que la soude soit en quantité suffisante pour saponifier complètement l’huile) et à
les mélanger intimement en les faisant bouillir en présence d’eau dans une cuve.
Le relargage : les deux produits sont séparés en ajoutant de l’eau salée. L’ensemble se divise en deux couches.
La partie inférieure, mélangée avec de l’eau, est retirée par le fond du chaudron à travers une tubulure.
La cuisson : la pâte de savon restant dans le chaudron est chauffée à ébullition pendant de nombreuses
heures avec un excès de soude caustique.
Les lavages : ils éliminent l’excès de soude restant dans le savon. On fait bouillir la pâte de savon avec de l’eau salée
en deux ou trois lavages successifs, jusqu’à ce que le savon ne contienne plus qu’une proportion donnée de soude.
Enfin, la pâte chaude du savon d’Alep est sortie de la cuve pour être étendue, sur une feuille de papier, afin
qu’elle refroidisse et perde une partie de son eau. »
D’après un article de la Compagnie Générale de Cosmétique.
1.1. Donner la formule chimique de la solution aqueuse d’hydroxyde de sodium ainsi que la formule du glycérol (ou
propan–1,2,3–triol).
1.2. Un des corps gras utilisés pour la fabrication du savon d’Alep est l’oléine de formule semi-développée :
Écrire l’équation chimique de la réaction associée à la transformation qui conduit au savon d’Alep.
1.3. D’après le texte, quel réactif est introduit en excès lors de la saponification ?
1.4. Les ions carboxylate présents dans ce savon comportent deux parties, une partie hydrophile et une partie
hydrophobe. Définir ces deux termes.
1.5. Donner la formule semi-développée de l’ion carboxylate en indiquant les deux parties précédemment citées.
1.6. Parmi les quatre techniques citées (soulignées dans le texte), laquelle est utilisée pour extraire le savon du
milieu réactionnel ? Expliquer le principe de cette technique.
2. Étude de la fabrication d’un parfum.
Le savon d’Alep est parfumé à partir d’essences naturelles. Aujourd’hui, de nombreux savons sont parfumés par
ajout d’un ester synthétique. On s’intéresse dans cette partie à la fabrication d’un ester dont l’odeur rappelle celle de
l’abricot. Il s’agit du butanoate de pentyle.
2.1. Estérification.
2.1.1. Donner les formules semi-développées et les noms respectifs de l’acide carboxylique A et de l’alcool B
qui réagissent pour donner le butanoate de pentyle.
2.1.2. Écrire l’équation chimique de la réaction d’estérification modélisant cette transformation.
2.1.3. Quelles sont les caractéristiques de cette transformation ?
... / ...

2.2. Suivi cinétique de l’estérification.
Afin de suivre l’évolution au cours du temps de l’avancement x de cette réaction chimique, on réalise l’expérience
suivante : on mélange 16,0 mL de l’acide carboxylique A pur, 0,170 mol de l’alcool B pur et 2,00 mL d’une solution
aqueuse d’acide sulfurique concentrée. Le mélange est réparti dans plusieurs ampoules chauffées à 50,0°C. À intervalles
de temps réguliers, on dose le contenu des ampoules par une solution d’hydroxyde de sodium de concentration molaire
volumique en soluté apporté : CB = 2,00 mol.L-1, en présence d’un indicateur coloré. L’équivalence du dosage est obtenue
pour un volume de solution d’hydroxyde de sodium noté VB équiv.
2.2.1. Le mélange réactionnel préparé est-il équimolaire ? Justifier.
Données : Pour l’acide carboxylique A : masse volumique : ρ
ρρ
ρA = 0,960 g.mL-1 ; masse molaire moléculaire : MA = 88,0 g.mol-1.
2.2.2. On plonge chaque ampoule dans l’eau glacée avant d’effectuer le dosage. Pourquoi ?
2.2.3. Lors de l’ajout de la solution d’hydroxyde de sodium, les ions hydroxyde réagissent simultanément avec
les deux acides présents dans l’ampoule :
– d’une part avec les ions oxonium H3O+(aq) libérés par l’acide sulfurique selon l’équation chimique :
H3O+(aq) + HO–(aq) →
→→
→ 2 H2O
– d’autre part avec l’acide carboxylique A (de formule notée R–CO2H) selon l’équation :
R–CO2H (aq) + HO–(aq) →
→→
→ R–CO2–(aq) + H2O.
Montrer que la quantité d’acide carboxylique A présent dans une ampoule à l’instant de date t est donnée par la relation :
nRCO2H = CB.VB équiv – n H3O+ où n H3O+ représente la quantité de matière d’ions oxonium libérés par l’acide sulfurique.
2.2.4. Montrer que l’avancement de la réaction d’estérification, à ce même instant de date t, a pour expression :
x (t) = nRCO2H (0) – CB.VB équiv + n H3O+. On pourra s’aider d’un tableau d’évolution du système.
2.2.5. À l’aide des données ci-dessous, calculer x60 l’avancement de la réaction à l’instant de date t = 60,0 min.
Données : – Un dosage par la solution d’hydroxyde de sodium des ions oxonium apportés par l’acide sulfurique dans
chaque ampoule fournit, après calculs, la quantité de matière en ions oxonium : n H3O+ = 3,20.10-3 mol.
– Quantité de matière d’acide carboxylique A introduit à t = 0 s : nRCO2H (0) = 2,30.10-2 mol.
– Volume équivalent de la solution d’hydroxyde de sodium versé lors du dosage d’une ampoule à l’instant
de date t = 60,0 min : VB équiv = 6,70 mL.
2.3. Les dosages ayant été effectués, on trace le graphe de la variation de l’avancement x de la réaction en
fonction du temps. On obtient la Courbe 1 ci-dessous.
Répondre par VRAI ou FAUX aux propositions données ci-dessous, en justifiant clairement la réponse.
2.3.1. Proposition 1 : On peut obtenir « davantage d’ester » en éliminant l’eau formée au cours de la transformation.
2.3.2. Proposition 2 : La vitesse volumique instantanée de la réaction augmente au cours du temps.
2.3.3. Proposition 3 : Le temps de demi-réaction vaut 100 min.
2.3.4. Proposition 4 : Si la température du milieu réactionnel augmente, on peut obtenir la Courbe 2 ci-dessus.
.../ p. 3

Terminale S D.S.T. N° 6 Page 3
II ] PHYSIQUE : sur 8 points.
LANC
LANCLANC
LANCER
ERER
ER DE POIDS
DE POIDS DE POIDS
DE POIDS
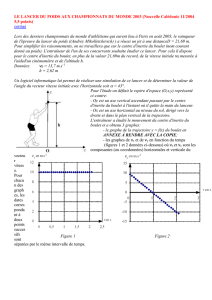
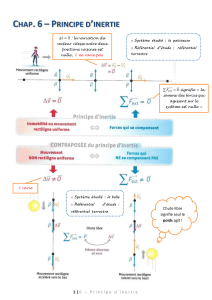
Lors des championnats du monde d'athlétisme qui eurent lieu à Paris en août 2003, le vainqueur de l'épreuve du
lancer du poids (Andrey Mikhnevich) a réussi un jet à une distance D = 21,69 m.
Pour simplifier les raisonnements, on ne travaillera que sur le centre d'inertie du boulet (nom courant donné au « poids »).
L'entraîneur de l'un des concurrents souhaite étudier ce lancer. Pour cela il dispose pour le centre d'inertie du
boulet, en plus de la valeur 21,69 m du record, de la vitesse initiale v0 mesurée à l'aide d'un cinémomètre et de l'altitude h.
Données : v0 = 13,7 m.s–1 ; h = 2,62 m.
Un logiciel informatique lui permet de réaliser une simulation de ce lancer et de déterminer la valeur de l'angle du
vecteur vitesse initiale avec l'horizontale soit : α
αα
α = 43,0°.
Pour l'étude, on définit le repère d'espace (O, x, y) représenté ci-contre.
Oy
JJJG
JJJGJJJG
JJJG est un axe vertical ascendant, passant par le centre d'inertie du
boulet à l'instant où il quitte la main du lanceur ; Ox
JJJG
J
JJGJJJG
J
JJG est un axe
horizontal au niveau du sol, dirigé vers la droite et dans le plan vertical
de la trajectoire.
L'entraîneur a étudié le mouvement du centre d'inertie du boulet et a
obtenu 3 graphes :
le graphe de la trajectoire : y = f(x) du boulet, donné sur l’Annexe,
à rendre avec la copie en indiquant son nom ;
les graphes de vx et de vy en fonction du temps (Figures 1 et 2
données ci-dessous) où vx et vy sont les composantes (ou
coordonnées) horizontale et verticale du vecteur vitesse.
Pour chacun des graphes, les dates correspondant à deux points
successifs sont séparées par le même intervalle de temps.
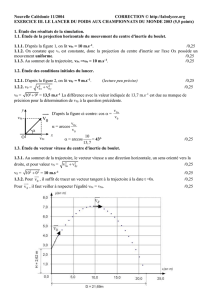
1. Étude des résultats de la simulation.
1.1. Étude de la projection horizontale du mouvement du centre d'inertie du boulet.
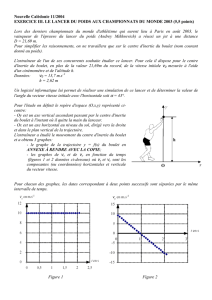
En utilisant la Figure 1, déterminer :
1.1.1. La composante v0x du vecteur vitesse du centre d'inertie du boulet à l'instant de date t = 0,00 s.
1.1.2. La nature du mouvement de la projection du centre d'inertie sur l'axe Ox
JJJG
J
JJGJJJG
J
JJG en justifiant la réponse.
1.1.3. La composante vSx du vecteur vitesse du centre d'inertie lorsque le boulet est au sommet S de sa trajectoire.
1.2. Étude des conditions initiales du lancer.
1.2.1. En utilisant la Figure 2, déterminer la composante v0y du vecteur vitesse à l'instant de date t = 0,00 s.
1.2.2. À partir des résultats précédents, vérifier que la valeur de la vitesse instantanée et l'angle de tir sont
compatibles avec les valeurs respectives v0 = 13,7 m.s–1 et α
αα
α = 43° données dans le texte.
1.3. Étude du vecteur vitesse du centre d'inertie du boulet.
1.3.1. Déterminer toutes les caractéristiques du vecteur vitesse du centre d'inertie du boulet au sommet de la trajectoire.
... / ...
Figure 1 Figure 2

1.3.2. Sur le graphe y = f(x) donné sur l’Annexe, à rendre avec la copie en indiquant son nom, tracer, sans
soucis d’échelle mais en cohérence avec les résultats des questions 1.1.1., 1.1.3., et 1.2.1. :
– le vecteur vitesse 0
v
du centre d'inertie du boulet à l'instant du lancer ;
– le vecteur vitesse S
v
du centre d'inertie du boulet au sommet de la trajectoire.
2. Étude théorique du mouvement du centre d'inertie.
Le boulet est une sphère de volume V et de masse volumique µ = 7,10.103 kg.m–3.
La masse volumique de l'air est µ' = 1,29 kg.m–3.
2.1. Exprimer littéralement la valeur PA de la poussée d'Archimède exercée par l'air sur ce boulet ainsi que la
valeur P de son poids. Montrer que PA est négligeable devant P.
2.2. Par application de la deuxième loi de Newton (ou théorème du centre d'inertie), déterminer le vecteur
accélération du centre d'inertie du boulet lors du mouvement. On supposera que, compte tenu des faibles
vitesses atteintes, les frottements dus à l'air au cours du jet sont négligeables.
2.3. Dans le repère d'espace défini en introduction, établir les équations horaires de la position du centre d’inertie
du boulet en fonction de v0 valeur de la vitesse initiale du jet et de α
αα
α l'angle initial de tir (angle entre
l'horizontale et le vecteur vitesse initiale 0
v
).
2.4. En déduire l'équation de la trajectoire du centre d'inertie du boulet.
3. Comment améliorer la performance d'un lanceur ?
L'entraîneur veut ensuite savoir sur quel(s) paramètre(s) il peut travailler pour améliorer la performance de l'athlète.
Celui-ci est plus petit que le recordman du monde, sa taille est telle que l'altitude initiale de ses lancers n'est au
maximum que de h' = 2,45 m.
L'entraîneur décide donc d'étudier l'influence de la valeur v0 de la vitesse initiale du lancer et de l'angle de tir α
αα
α.
Il réalise des séries de simulations rassemblées dans les réseaux de courbes correspondants aux Figures 3 et 4.
Sur la Figure 3, l'angle de tir est maintenu constant soit : α
αα
α = 41,0°.
Sur la Figure 4, la vitesse est maintenue constante soit : v0 = 13,8 m.s–1.
Figure 3 (
α
αα
α
= 41,0°)
Figure 4 (v0 = 13,8 m.s –1)
.../ p. 5

Terminale S D.S.T. N° 6 Page 5
3.1. À partir des Figures 3 et 4, entourer, dans le tableau donné sur l’Annexe, à rendre avec la copie en indiquant
son nom, la proposition correcte donnant l'évolution de la longueur du jet pour :
– l'angle
α
αα
α fixé ;
– la valeur v0 fixée.
3.2. Confronter les Figures 3 et 4 pour en déduire si, parmi les combinaisons proposées, il en existe une
satisfaisante pour battre le record du monde. Justifier la réponse.
ANNEXE À RENDRE AVEC LA COPIE
en indiquant son NOM :
Angle α
αα
α fixé Vitesse initiale v0 fixée
Quand v0 augmente, la distance horizontale D du jet :
– augmente ;
– diminue ;
– est la même ;
– augmente, passe par un maximum puis diminue ;
– diminue, passe par un minimum puis augmente.
Quand α
αα
α augmente la distance horizontale D du jet :
– augmente ;
– diminue ;
– est la même ;
– augmente, passe par un maximum puis diminue ;
– diminue, passe par un minimum puis augmente.
1
/
5
100%