Histoire naturelle du cancer (Chapitre 9)

Copyright AFECAP 1
Histoire naturelle du cancer (Chapitre 9)
Auteurs : V. Costes, S. Guyetant
Mai 2005
Pré requis :
• Connaître l'anatomie du système lymphatique et de la grande circulation
• Connaître les caractéristiques morphologiques des cellules cancéreuses
Objectifs
• Savoir ce qu'est la dysplasie en pathologie tumorale, et en connaître des
exemples
• Définir un carcinome in situ et comprendre les conséquences pratiques de ce
diagnostic
• Citer les différentes étapes du processus métastatique
• Connaître les grandes voies de dissémination métastatiques des cellules
cancéreuses
• La localisation des métastases par voie hématogène n'est pas aléatoire. Citer les 2
théories proposées pour expliquer l'existence de sites métastatiques préférentiels
et illustrer chacune par 2 exemples
Références
• site d’oncologie générale de la faculté de médecine de Caen :
http://www.oncoprof.net/
• Cancer Medecine, 5th edition, Robert C. Bast Jr., Donald W. Kufe, Raphael E.
Pollock, Ralph R.Weichselbaum, James F. Holland, Emil Frei, B.C. Decker Inc.
2000 (section 5) en accès gratuit (en anglais) sur :
http://freebooks4doctors.com/
1. INTRODUCTION
L'histoire naturelle d'un cancer peut être divisée schématiquement en plusieurs étapes:
• la transformation cancéreuse d'une cellule
• l'expansion clonale de la cellule cancéreuse (théorie clonale du cancer)
• la croissance de la masse tumorale qui devient cliniquement détectable et l'invasion
locale avec envahissement loco-régional par le tissu cancéreux
• la dissémination des cellules cancéreuses à distance du foyer tumoral initial et la
formation de foyers tumoraux secondaires = les métastases.
Cette progression tumorale est liée à l'instabilité génétique des cellules cancéreuses. Des
modifications génétiques spontanées vont survenir progressivement, avec apparition de
variants du clone initial, entraînant une hétérogénéité de la tumeur. Ces clones variants auront
des comportements prolifératifs, invasifs, antigéniques, et métastatiques hétérogènes, ou
encore une sensibilité inégale à la chimiothérapie.

Copyright AFECAP 2
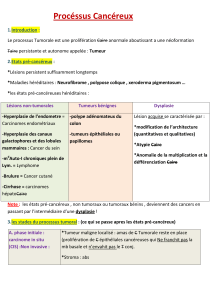
2. ETATS PRECANCEREUX ET PHASE INITIALE DU CANCER
Tous les épithéliums reposent sur une membrane basale qui sépare les cellules épithéliales du
tissu conjonctivo-vasculaire sous-jacent appelé chorion. Les étapes du développement d'un
carcinome (= cancer d'origine épithéliale) avant la phase d'invasion correspondent aux étapes
strictement intra-épithéliales de la carcinogenèse.
On distingue 2 étapes : les dysplasies et le carcinome in situ.
2.1. Conditions et lésions précancéreuses, notion de dysplasie
Les conditions précancéreuses sont des états cliniques associés à un risque significativement
élevé de survenue de cancer. Elles permettent de déterminer des populations à risque pour un
cancer donné.
Les lésions précancéreuses sont des anomalies histopathologiques qui peuvent aboutir à
l'apparition d'un cancer (gastrites chroniques...). Certains cancers apparaissent aussi sur des
lésions pré-existantes, comme les carcinomes développés sur des cicatrices de brûlure ou des
lésions de radiodermite.
Une condition précancéreuse est donc distincte d'une lésion précancéreuse.
Exemple : la polypose colique familiale est une condition précancéreuse, car cette maladie
entraîne un risque important de cancer du colon. Elle se traduit en particulier par la survenue
de nombreux adénomes coliques. Ces adénomes comporteront des lésions de dysplasie (lésion
précancéreuse).
Certaines lésions précancéreuses sont appelées dysplasies. Les dysplasies sont des troubles
acquis de la multiplication cellulaire résultant d'anomalies génétiques qui altèrent le contrôle
de la prolifération cellulaire, et sont responsables d'anomalies de maturation cellulaire. Les
dysplasies ne sont décrites que dans les épithéliums (col utérin, tube digestif, voies aériennes,
glande mammaire, voies urinaires...) et sont des lésions précancéreuses car les cellules
dysplasiques peuvent, inconstamment et dans un délai très variable, se transformer en cellules
cancéreuses par accumulation d'autres anomalies génétiques.
NB : le terme de "dysplasie" a un deuxième sens, plus près de son étymologie ( dys / anomalie
; platein / construire)(cf chap 5). Il désigne toute lésion résultant d'une anomalie du
développement d'un tissu, d'un organe ou d'une partie de l'organisme (par exemple, dysplasie
rénale, dysplasie dentaire). Il est également utilisé pour désigner certaines maladies

Copyright AFECAP 3
constitutionnelles rares, à caractère malformatif plus ou moins manifeste (exemple : dysplasie
fibreuse des os).
Des états dysplasiques peuvent survenir :
• à l'occasion d'un état inflammatoire chronique (ex: gastrite chronique à Hélicobacter ;
métaplasie glandulaire du bas oesophage par reflux acide chronique :
endobrachyoesophage ; certaines maladies inflammatoires chroniques intestinales)
• sur des infections virales (condylomes à papillomavirus du col utérin)
• dans des tumeurs bénignes (adénomes du colon).
Caractères microscopiques des dysplasies
L'état dysplasique peut être diagnostiqué par l'examen anatomo-pathologique, cytologique
et/ou histologique :
• mitoses en nombre augmenté,
• augmentation des rapports nucléo-cytoplasmiques,
• anisocytose et anisocaryose,
• diminution de la différenciation cellulaire
• troubles de la polarité cellulaire, désorganisation de l'épithélium
adénome colique
(fig9.12)
Ces anomalies microscopiques sont plus ou moins intenses, et ceci est la base de la notion de
grade : l'anatomo-pathologiste doit non seulement reconnaître une dysplasie mais doit
indiquer son grade c'est-à-dire son intensité. En règle, plus la dysplasie est marquée, plus le
risque de transformation en cancer à plus ou moins court terme est élevé.
Le grade a donc pour but de proposer un pronostic pour guider l'attitude thérapeutique.
Différentes terminologies sont employées pour qualifier les différents grades de dysplasie :
• dysplasies légère, modérée et sévère (OMS)
• néoplasie intra-épithéliale (NIE) de degrés I, II et III
• dysplasies de bas grade et de haut grade.
2.2. Le carcinome in situ (CIS)

Copyright AFECAP 4
2.2.1. Définition
Au niveau des épithéliums, séparés du tissu conjonctif par une membrane basale bien
distincte, il est possible de décrire un stade de carcinome in situ : prolifération de cellules
épithéliales cancéreuses qui intéresse toute la hauteur de l'épithélium mais qui ne franchit
pas la membrane basale de l'épithélium, et donc n'envahit pas le tissu conjonctif. Le
carcinome in situ est aussi dit "non invasif".
A ce stade , les cellules cancéreuses ne sont pas accompagnées par un stroma.
En pratique, les termes de carcinome in situ et de dysplasie sévère (ou de haut grade) sont
souvent employés comme synonymes.
2.2.2. Localisations : ce sont celles des dysplasies
• col utérin
• autres muqueuses malpighiennes (lèvres et bouche, oesophage, larynx, muqueuses
génitales, bronches après métaplasie malpighienne) et peau
• urothélium (vessie surtout)
• muqueuses digestives (surtout à partir des adénomes, parfois aussi en muqueuse plane
: par exemple sur une métaplasie intestinale gastrique ou du bas œsophage
(endobrachyoesophage)
• sein : carcinome lobulaire in situ touchant les petits acini mammaires, ou carcinome
intra-canalaire dans les canaux excréteurs galactophores
2.2.3. Diagnostic : il est microscopique, sur des biopsies ou
sur des pièces opératoires
*en effet il n'y a pas de masse tumorale et les modifications macroscopiques sont minimes
(mais elles peuvent permettre d'orienter des biopsies et donc de dépister le cancer in situ)
*Les anomalies sont celles de cellules cancéreuses (cf chapitre 8) et sont difficiles à distinguer
d'une dysplasie sévère ou de haut grade mais, en pratique, ceci n'a pas d'importance car
l'attitude thérapeutique est identique qu'il s'agisse d'une dysplasie sévère ou d'un carcinome in
situ. Le point important du diagnostic est ici, par définition, l'intégrité de la membrane
basale et donc l'absence d'envahissement cancéreux du tissu conjonctif.
Condylome
(fig9.10)
Carcinome in situ

Copyright AFECAP 5
(fig9.09)
Carcinome épidermoïde microinvasif
(fig9.08)
Schéma d'un carcinome micro invasif
(fig9.13)
NB : Un diagnostic de certitude repose sur l'étude histopathologique de la totalité de la lésion
(pour être sûr que le carcinome est "in situ" dans toute la lésion), donc sur une pièce d'exérèse.
Sur une biopsie, l'anatomo-pathologiste ne peut répondre que "aspect de CIS" (= CIS dans la
limite de la biopsie examinée). Sur des prélèvements cytologiques, on peut suspecter
l'existence de cellules cancéreuses mais on ne peut dire si le carcinome est in situ ou invasif.
2.2.4. Evolution
• un CIS peut demeurer non invasif pendant plusieurs années
• un CIS évolue spontanément dans la très grande majorité des cas en un carcinome
invasif (mais il existe de très rares régressions spontanées)
• le schéma évolutif "dysplasie → CIS → carcinome invasif", s'il est très fréquent, n'est
probablement pas applicable à tous les carcinomes.
On peut dépister un carcinome in situ et ceci est très important pour le pronostic : en effet, au
stade de carcinome in situ, aucune métastase ne s'est constituée. Le traitement peut être local
et limité, et conduire à la guérison.
3. PHASE LOCALE DU CANCER : L'INVASION
3.1. Aspects fondamentaux
Remarque préliminaire : l'invasion locale et les métastases sont deux caractéristiques
essentielles des cancers et sont responsables de leur morbidité et de leur mortalité. Pour des
raisons pratiques, ces deux phases sont séparées ici en deux chapitres différents, mais bon
nombre des mécanismes impliqués dans l'invasion et le processus métastatique sont
communs.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%