4δ+ 3δ− δ+ δ+ δ+ G+ - Lycée Gustave Flaubert Rouen

Première S1, Évaluation n°7
,
29/05/2012 durée : 1h 20min
Données :
Élément
H
C
N
Cl
O
Fe
M(g.mol
-
1
)
1,0
35,5
16,0
55,8
Electronégativités
croissantes
de H à 0
Les électronégativités des atomes C et H sont presque égales dans les molécules d’hydrocarbure
I- Dissolution d’un solide dans un solvant polaire ou apolaire
Le cyclohexane C
6
H
12
, le tétrachlorométhane CCl
4
et l’ammoniac NH
3
sont trois solvants utilisés
en chimie organique. Leurs modèles moléculaires sont respectivement :
1.
2. a) Écrire les formules de Lewis des trois molécules _
|Cl| H
_ | _ |
|Cl - C – Cl| H – N – H
|
|Cl|
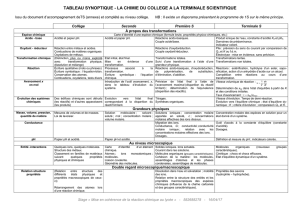
b) Indiquer, sur chacun des modèles ci-dessus, les charges partielles éventuelles (δ
δδ
δ
+
++
+
, δ
δδ
δ
−
−−
−
)
portées par les atomes de la molécule
les atomes C et H de la molécule de cyclohexane ont la même électronégativité
donc ne portent pas de charge partielle
Les molécules sont électriquement neutres donc les sommes des charges partielles
positives d’une part et négatives d’autre part sont égales en valeur absolue
c) Préciser les positions des barycentres G
+
++
+
et G
−
−−
−
des charges partielles positives et
négatives (
quand elles existent
) et en déduire si la molécule est polaire ou apolaire
- molécule C
6
H
12
apolaire pour la raison indiquée au b)
- molécule CCl
4
apolaire car G
+
et G
-
confondus situés au centre de l’atome C
- molécule d’ammoniac polaire car G
+
et G
-
séparés (G
+
au centre du triangle
équilatéral formé par les atomes d’hydrogène et G
-
au centre de l’atome N)
3. Le diiode I
2
forme un solide moléculaire.
a) Nommer et définir l’interaction qui assure la cohésion du cristal de diiode
interaction de Van der Waals entre les nuages électroniques des atomes d’iode de
molécules différentes
b) La molécule de diiode est-elle polaire ou apolaire ? Dans quel(s) solvant(s) est-il
soluble ? Justifier les réponses
molécule I
2
apolaire car formée de deux atomes identiques; le diiode est donc
soluble dans un solvant apolaire comme le cyclohexane ou le tétrachlorocarbone
4δ
4δ4δ
4δ
+
++
+
δ
δδ
δ
−
−−
−
δ
δδ
δ
−
−−
−
δ
δδ
δ
−
−−
−
δ
δδ
δ
−
−−
−
3
33
3δ
δδ
δ
−
−−
−
δ
δδ
δ
+
++
+
δ
δδ
δ
+
++
+
δ
δδ
δ
+
++
+
G
+
G
-
G
+
G
-

II- Préparation d’une solution ionique
L’aide de laboratoire du lycée prépare une solution aqueuse de volume V= 250 mL en
dissolvant une masse m= 10,8 g de cristaux ioniques de chlorure de fer (III) hexahydraté
de formule, FeCl
3
,6H
2
O
et de masse molaire, M= 270,32 g.mol
-1
1. a) Quel est la nature de l’interaction assurant la cohésion du solide ?
Interaction électrique attractive entre les ions de signes contraires et répulsive
entre les ions de même signe
b) En représentant les ions Fe
3+
et Cl
-
du solide par des sphères, schématiser le
phénomène d’hydratation des ions au cours de la dissolution du solide dans l’eau.
Fe
3+
Cl
-
Les molécules d’eau polaires sont attirées électriquement par les ions en orientant
leur pôle négatif vers les ions positifs et leur pôle positif vers les ions négatifs
c) Écrire l’équation de dissolution.
(Rappel : Les molécules d’eau n’apparaissent pas)
FeCl
3(s)
Fe
3+(aq)
+ 3Cl
-(aq)
2. Vérifier la valeur de la masse molaire et calculer la quantité de matière
n
de chlorure
de fer (III) dissous.
M = M
Fe
+ 3M
Cl
+ 12M
H
+ M
O
= 55,8 + 3
x
12,0 + 12
x
1,0 + 16,0 = 270,3 g.mol
-1
n = m/M = 10,8/270,32 = 0,0400 mol
3. a) Établir le tableau d’avancement de la réaction de dissolution
État du
système Avancement
FeCl
3(s)
Fe
3+(aq)
+ 3Cl
-(aq)
initial
0
n=
0,0400 mol
0 0
intermédiaire
x n-x x 3x
final x
max
n-x
max
= 0 x
max
3x
max
b) Déduire les quantités de matière
n
1
d’ions fer (III) et
n
2
d’ions chlorure obtenues.
Dans l’état final le chlorure de fer est totalement dissous donc x
max
=n=0,0400mol
alors n
1
= x
max
= 0,0400 mol et n
2
= 3x
max
= 3
x
0,0400 = 0,120 mol
c) Calculer les concentrations effectives en ions fer [Fe
3+
] et en ions chlorure [Cl
-
]
dans la solution.
[Fe
3+
] = n
1
/V = 0,0400/0,250 = 0,160 mol.L
-1
[Cl
-
] = n
2
/V = 0,120/0,250 = 0,480 mol.L
-1
III- Alcanes et Alcools
On considère les molécules : (A) (B)
(C) (D) (E) pentan-2-ol
H
δ+
O
2δ−
H
δ+
H
δ+
2δ−
Ο
H
δ+
H
δ+
2δ−
Ο
H
δ+
H
δ+
O
2δ−
H
δ+

1) Nommer les molécules A, B, C, D, écrire la formule semi-développée de la molécule E
et préciser la classe des alcools.
(A): propane (B): 2-méthylbutane (C): 2,3-diméthylhexane
(D): propan-1-ol ; alcool primaire (E): CH
3
– CH –CH
2
– CH
2
– CH
3
|
OH
2) Quelle interaction assure la cohésion d’un alcane à l’état liquide ?
Classer les alcanes ci-dessus par température d’ébullition croissante en justifiant.
interaction de Van der Waals ; (A) (B) (C) car plus le nombre d’atomes de
carbone est élevé et plus l’interaction de Van der Waals entre molécules
est importante donc plus il faut chauffer pour séparer les molécules
3) Nommer et définir l’interaction existant entre les molécules (D) et ne pouvant pas
exister entre les molécules (A). Lequel de ces deux composés a alors la température
d’ébullition la plus élevée ? Lequel est le plus volatil ?
- Interaction par liaison hydrogène entre l’atome O de la liaison O-H d’une
molécule (D) et l’atome H de la liaison O–H d’une autre molécule (D) ;
- (D) a alors la température d’ébullition la plus élevée
(car il faut chauffer
davantage pour rompre les liaisons hydrogène)
- (A) de température d’ébullition plus faible est le plus volatil
4) Indiquer l’alcool totalement miscible à l’eau ; quelle interaction explique cette
miscibilité ?
Le propan-1-ol en raison des liaisons hydrogène entre les molécules d’alcool et
les molécules d’eau
1
/
3
100%