Télécharger - Cours PAES Bobigny

Mr Oudar
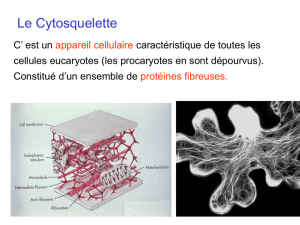
Chapitre 5 : Le Cytosquelette
Observé en 1950 pour la première fois, et en particulier dans le fuseau mitotique (de division). 1965,
ils ont été isolé et caractérisés. Après cette découverte on a mis en évidence des associations de
certaines protéines, des éléments aussi du cytosquelette à savoir un certain nombre de filaments
qui n’ont pas d’activité contractile (contrairement aux microfilaments d’actines) ce sont les filaments
intermédiaires (à diamètre et structure intermédiaire entre les microfilaments les plus petits, et les
microtubules) Il y a trois classes d’éléments du cytosquelette qui constitue l’ensemble des éléments
du cytosquelette :
Les microfilaments d’actines ; 6 à
8 nm
Les Microtubules : 25nm,
éléments communs à toutes les
cellules
Les Filaments intermédiaires : 11
nm de diamètre (ils sont
spécifique de certain types
cellulaire, ils caractérisent
certain types cellulaire).
Ce terme de cytosquelette n’est pas trop approprié (ce n’est pas quelque chose de fixe), ce
cytosquelette il est en perpétuel remaniement dans les cellules, il va être sujet a des phénomènes de
formation, polymérisation, et de déformation c’est à dire dépolymérisation. Ce cytosquelette est
présent de façon ubiquitaire dans les cellules , on le retrouve en périphérie des cellules , dans le
cytosol en particulier sous la membrane plasmique c’est ce qu’on appelle ‘’le cortex cellulaires’’ , il y
est ailleurs dans le cytosol reparti un peu partout ( c’est d’ailleurs l’endroit où sont fabriqué les
éléments du cytosquelette) , et spécifiquement dans les noyau des cellules c’est-à-dire dans les
nucléoplasme avec des filaments intermédiaires de types lamine .
Trois grande classes des éléments du cytosquelette mais on va voir d’un point de vue organisation
moléculaires, il y a cependant deux types de monomères protéique qui entrent dans la constitution
de ces trois classes d’éléments du cytosquelette, d’une part sous forme de protéines globulaires
(micro filaments d’actine et les microtubules) qui vont être dus à des phénomènes de
polymérisation. Tandis que le deuxième élément est constitué de protéines fibreuse avec un
domaine central organisé en hélice alpha, qui en s’associant vont former les filaments intermédiaires.
Non seulement ,Il y a deux types de macromolécules soit globulaires soit fibreuses ,mais à l’intérieur
d’une cellule ces éléments du cytosquelette apparaissent sous trois formes différentes , d’une part
des monomères libres (dans le cas où elles viennent d’être synthétisées dans le cytosol ) , ou des
molécules qui proviennent de ces dépolymérisation qui libère des monomères dans le cytosol , on
retrouve aussi des molécule sous forme de polymère instables dans lesquels on observe des
polymérisation et dépolymérisation se produisant à des fréquences relativement élevées . On

Mr Oudar
retrouve aussi des polymères sous forme stables ceux-ci grâce à des associations entre éléments du
cytosquelette ou grâce aux interactions de protéine spécifique associées à tels ou tels types
d’éléments du cytosquelette. Ces éléments du cytosquelette subissent un certain nombre de
modification qui sont à l’origine de leur organisation, en particulier parmi les différentes
modifications, on a des polymères phosphorylés ou qui seront déphosphorylés, des polymères qui
subissent des accrochages de sucres (réaction de o glycosylation), ceci pour aboutir à des formes
stabilisées. De même un certain nombre de monomères (actine et microtubule) sont susceptibles de
fixer des ribonucléotide, soit sous forme Atp (actine) soit sous forme Gtp (tubuline)
Ces polymères une fois formés, peuvent interagir soit avec des protéines associées soit aux
microfilaments d’actines soit aux microtubules (appelés MAP) soit aux filaments intermédiaires, par
ailleurs les éléments du cytosquelette peuvent s’associer entre eux. Des associations possibles avec
des constituants soit des édifices des molécules macro moléculaires, avec les membranes aussi par
exemple.
1) Les micros filaments d’actine : (Diamètre 6 a 8nm)
Ils proviennent d’un phénomène de polymérisation de l’actine G, celle-ci est mise en évidence dans
les cellules musculaires (fibres musculaires striée plus précisément). Les fibres des cellules
musculaires sont organisées en myofibrille qui est des associations de filament épais (myosine) et
filament fins (filament d’actine), c’est le glissement de ces fibres qui permettent d’une part la
contraction et d’autre part la décontraction musculaire. Il existe dans ce type de cellules trois classe
d’actines : l’actine de type ALPHA (présente dans les cellules musculaire, lisse, strié, squelettique ou
cardiaque), BETA et GAMMA dans les cellules non musculaires. Cette actine dans les cellules elle
existe sous deux forme, soit sous forme globulaire c’est l’actine G, soit lorsque ces molécules d’actine
G qui s’associent pour donner des fibres c’est l’actine F.
1.1) Les différentes classes d’actine :
1.1.1) L’actine G
L’actine G, 42kda constituée d’une seule chaine
polypeptidique de 364 aa, est d’une forme
globuleuse, à l’intérieur, la conformation de cette
protéine fait apparaitre un sillon profond qui va
être le siège de la fixation de la molécule de
ribonucléotide en particulier de l’Atp (ou l’Adp).
Si l’actine G n’est pas liée à l’atp ou l’adp, c’est
une molécule très fragile, elle est susceptible de
se dénaturer très vite. Il y a aussi des sites de
fixation au Mg nécessaires pour la formation de ses polymères. La fixation de l’Atp provoque une
modification de la conformation de la molécule il y aura ensuite polymérisation, l’Atp sera hydrolysé
en Adp cet Adp reste fixé sur le sillon, lorsqu’il y aura libération de cet Adp c’est là qu’il y aura
polymérisation.

Mr Oudar
1.1.2) L’actine F :
Ces molécules d’actine G se lient entre elles pour donner les filaments
d’actine F, les nucléotides qui viennent se fixer sur le sillon, sont tous
orientés vers l’extérieur de la molécule, chaque monomère est décalé
dans la fixation l’un par rapport à l’autre, et ce décalage qui donne
l’impression dans l’actine F d’un polymère de deux chaine enroulé
ensemble ce qui n’est pas le cas (ce n’est pas une hélice). Actine F de
diamètre 6 à 8 nm avec un pas de 37nm. Dans les cellules non
musculaires, l’actine F se polymérise et dépolymérise en permanence, à
l’inverse dans les cellules musculaires il n’y a pas ces phénomènes, ils
sont sous formes stabilisé grâce à la fixation d’un certaine nombre de
protéine.
La polymérisation commence avec la formation d’un
noyau de monomère ,3 monomères qui s’associent
pour former un noyau à partir duquel des
monomères d’actine G viennent se fixer et donne
cette polymérisation, c’est la phase de nucléation,
phase dépendante de la concentration en ion, en Mg,
en K, en concentration en Atp et en actine G. Quand
toutes ses conditions sont réunies l’actine G s’associe
sous forme trimère, cette trimère forme un noyau
qui va permettre de former un noyau et permettre
l’élongation du polymère. Il y a eu changement de
conformation du monomère ceci est dû à la fixation
un cation.
Ces site de nucléation ne sont pas n’importe où dans la cellule, ils sont liées du côté de la membrane
(cortex cellulaire) et c’est sur ce côté que ces filaments sont susceptible de s’ancrer a la membrane
plasmique. Les deux extrémités des microfilaments d’actine ne sont pas équivalentes, une positive
et l’autre négative (rien à voir avec les courant électrique) ça a rapport avec la vitesse de formation,
c’est du côté + qu’il va y avoir encrage avec la membrane plasmique .Il y a des monomère liés a de
l’atp, ces trois monomère constituent un trimère instable, cette phase de nucléation suivie, par une
phase au cours de laquelle les molécules d’actine s’associe. A chaque fois qu’un monomère (qui était
libre) s’associe a de l’actine F cela conduit à une diminution en concentration d’actine G (libre) On va
atteindre une phase de concentration critique et lorsqu’elle sera atteinte, à partir de ce stade les
molécules d’actine G vont s’associer à la même vitesse qu’elles se dissocient. Au cours de ses deux
phases les molécules d’Atp vont se fixer sur l’actine G, l’hydrolyse de l’Atp en Adp c’est ce qui
provoque la polymérisation (L’ADP quitte la cellule qu’au moment de la dépolymérisation).

Mr Oudar
Quand on observe ces micro filaments d’actine au ME on voit que les deux extrémités ne sont pas
équivalentes (+,- polarisation) la polymérisation est plus importante de la côte + que du côté – (5 à
10 fois plus). Il peut se faire que la concentration diminue (‘inferieure a la concentration critique) les
microfilaments d’actine vont se raccourcir pour libérer des monomères.
1.2) Les protéines associés (de liaison) à l’actine :
Il existe un certain nombre de substance (Cytokalasine, extraites de champignon microscopique)
agissant sur ces phénomènes de polymérisation, en inhibant la polymérisation de l’actine G, elles se
fixent sur les extrémités + et bloque la polymérisation. D’autre substance (champignon
macroscopique : Phaloidine) elles inhibent la dépolymérisation des cytokalasine inhibant la
polymérisation, en se fixant sur les coté des filaments d’actine, en bloquant le départ de molécule
d’actine G (elles ont tendances à stabiliser ces microfilament).
Il existe des protéines de type ABP, capables de s’associer au microfilament d’actine, permettant un
certain nombre de phénomènes biologiques.
Le premier groupe : intervenant dans la poly et dépolymérisation : la thymosine, la caldésmone,
la profiline. Qui peuvent permettre un certain nombre d’interaction avec l’actine.
C’est le cas de la Tymosine. Donc cette Thymosine bloque la polymérisation , elle empêche la
molécule de se polymériser .
La Profiline elle, favorise la polymérisation, elle permet d’échanger de façon meilleure, les échanges
entre l’atp et l’ADP (même fonction que la molécule l’arc de 3)
La caldésmone, vient se fixer du côté de l’actine F, et va avoir comme fonction principale de
stabiliser le microfilament d’actine dans les cellules.
Le deuxième groupe : permettent la stabilisation et surtout l’organisation du microfilament
d’actine.
C’est le cas de la Tropmyosine, susceptible de venir se fixer sur les microfilaments d’actine.
La Fimbrine, et la Viline (protéines de types microvillosité) permettent la formation de faisceaux
serrés de microfilament d’actine. Il y a possibilité d’association avec l’alpha Actinine, formant des
faisceaux larges.
Les microfilaments d’actine, sont en organisé soit en faisceaux parallèles soit sous forme de réseaux,
ceci grâce à la Filamine qui permet leur organisations dans différents sens.
Troisième groupe, détruisent les filaments d’actine qui conduisent à des fragmentations de
microfilament d’actine c’est le cas de la Gelsonine.
1
/
4
100%