Lire l`article complet

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XIV - n° 5 - mai 2010
129
Échos des congrès
L
e Dr Emmanuel Baetge (San Diego) est consi-
déré comme le leader mondial de la production
de cellules β pancréatiques à partir de cellules
souches humaines embryonnaires. Il a donné une
conférence plénière au congrès de la SFD 2010 et a
fait le point sur ce sujet. Ce dernier représente un enjeu
énorme sur le plan thérapeutique. En eet, l’objec-
tif principal est de pouvoir à long terme greer des
cellules β générées in vitro à des patients atteints de
diabète de type 1. Des grees d’îlots qui provenaient
de donneurs cadavériques avaient déjà été réalisées
par le laboratoire du Dr James Shapiro à Edmonton en
2000. Ces traitements nécessitaient une forte immuno-
suppression pour éviter le rejet du greon. Ces essais
cliniques étaient encourageants car les greons avaient
permis une normalisation de la glycémie chez la majo-
rité des patients pendant la première année après la
gree. Néanmoins, une limite importante reste la faible
disponibilité des cellules β. Le laboratoire d’E. Baetge
essaie donc d’utiliser des cellules souches pour obtenir
de nouvelles sources de cellules β. Les cellules souches
ont une forte capacité de prolifération, et il semble pos-
sible d’orienter in vitro leur diérenciation en cellules β.
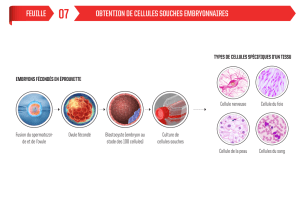
Pour cela, E. Baetge essaie de reproduire les étapes du
développement embryonnaire an d’obtenir in vitro
des cellules β qui ressemblent le plus possible à celles
que l’on pourrait trouver chez des individus. Les étapes
de la diérenciation sont les suivantes : des cellules
souches se diérencient en endoderme indiérencié,
puis en endoderme digestif, en endoderme pancréa-
tique, en cellules endocrines et enn en cellules β.
Selon E. Baetge, le point clé de l’étape initiale a été
de réduire la concentration de sérum dans le milieu
de culture pour générer de l’endoderme dénitif à
partir des cellules souches. En eet, la signalisation
par la phospho-inositol 3 kinase (PI3 kinase) peut
être stimulée par le sérum et empêche la formation
d’endoderme. Ensuite, pour la deuxième étape, des
facteurs de croissance tels que le keratinocyte growth
factor (KGF) et le broblast growth factor 2 sont ajoutés
dans la culture. Ces facteurs ont été décrits par le labo-
ratoire du Dr R. Scharfmann (Paris) pour leur capacité
à stimuler la prolifération des cellules progénitrices.
Dans le cas du protocole d’E. Baetge, l’addition de KGF
et FGF2 permet d’obtenir de l’endoderme dénitif.
Ensuite, l’addition d’acide rétinoïque et de protéine
de morphogenèse osseuse permettra d’obtenir un
endoderme digestif qualié de “prépancréatique”. Le
tissu obtenu contiendra des cellules exprimant des
facteurs de transcription pancréatiques, dont Pdx1
et Nkx6.1, mais aussi quelques cellules exprimant l’in-
suline, la somatostatine, le polypeptide pancréatique
et la ghréline. Lorsque cet endoderme est greé chez
la souris, il est capable de sécréter de l’insuline en
réponse au glucose. Cette fonction augmente avec
le temps après la gree. Si on détruit les cellules β
endogènes de souris avec une toxine, la streptozoto-
cine, la gree d’endoderme généré à partir des cellules
souches humaines permet de rétablir une glycémie
normale. Cette expérience démontre que l’endoderme
humain produit in vitro est une source de cellules β
fonctionnelles. On cherche maintenant à utiliser des
agrégats de cellules générées in vitro pour reproduire
la structure et la vascularisation des îlots. Il s’agit éga-
lement d’utiliser des méthodes d’encapsulation qui
permettraient de protéger les cellules greées tout
en permettant une libération adéquate des hormones
pancréatiques.
En conclusion, ces travaux semblent extrêmement
prometteurs quant à la production de cellules β in vitro.
Toutefois, certains points nécessitent absolument d’être
améliorés. En eet, dans un nombre non négligeable
de cas, la gree de cellules d’endoderme humain chez
la souris forme des tératomes. De nouveaux moyens
devront donc être utilisés pour éviter la formation de
tumeurs. De plus, il sera nécessaire de dénir la dose
de cellules utilisée, leur site d’insertion pour une bonne
libération des hormones, et enn de régler les pro-
blèmes de rejet et d’auto-immunité liés au diabète de
type 1.
■
Société francophone du diabète (SFD)
Des cellules souches induites
pour le traitement du diabète
Lille, 16-19 mars 2010
Bertrand Duvillié*
* Inserm U845,
faculté Necker.
© Tous droits réservés.
1
/
1
100%