Gélose TSC (base)

1/6
Biokar Diagnostics – Rue des Quarante Mines – ZAC de Ther – Allonne – B.P. 10245 – F60002 Beauvais Cedex – France
Tél : + 33 (0) 3 44 14 33 33 – Fax : +33 (0) 3 44 14 33 34 – www.biokar-diagnostics.fr
Gélose TSC (base)
DOMAINE D’UTILISATION / HISTORIQUE
La gélose Tryptone-Sulfite-Cyclosérine (TSC) a été décrite par Harmon pour l’isolement sélectif
et le dénombrement de Clostridium perfringens dans les eaux et les produits alimentaires. Ce
milieu est également recommandé pour le dénombrement des anaérobies sulfito-réducteurs dans
les denrées d’origine animale.
PRINCIPES
- Les microorganismes sulfito-réducteurs réduisent le sulfite de sodium en sulfure, provoquant
avec le citrate ferrique un précipité noir de sulfure de fer autour des colonies.
- Pour effectuer le dénombrement des Clostridium perfringens, il est recommandé d’incuber le
milieu à 37°C et de procéder ensuite à la confirmation des colonies caractéristiques.
- La flore contaminante est presque totalement inhibée par la D-cyclosérine qui diminue
également la taille des halos noirs se développant autour des colonies.
PREPARATION
- Mettre en suspension 42,0 g de milieu déshydraté de base (BK031) dans 1 litre d’eau distillée
ou déminéralisée.
- Porter lentement le milieu à ébullition sous agitation constante et l’y maintenir durant le temps
nécessaire à sa dissolution.
- Répartir en tubes, à raison de 20 mL par tube, ou en flacons à raison de 100 mL par flacon.
- Stériliser à l’autoclave à 121°C pendant 15 minutes.
NOTA :
Avec le milieu de base prêt-à-liquéfier BM039, BM077 (ou bien si le milieu est préparé à l’avance,
à partir du milieu de base déshydraté), faire fondre la gélose pendant le minimum de temps
nécessaire à sa reliquéfaction totale. Refroidir et maintenir le milieu à 44-47°C.

2/6
Biokar Diagnostics – Rue des Quarante Mines – ZAC de Ther – Allonne – B.P. 10245 – F60002 Beauvais Cedex – France
Tél : + 33 (0) 3 44 14 33 33 – Fax : +33 (0) 3 44 14 33 34 – www.biokar-diagnostics.fr
MODE D’EMPLOI
UTILISATION EN TUBES (avec D-cyclosérine)
- Dans chaque tube, ajouter stérilement 0,2 mL de supplément sélectif D-cyclosérine 200 mg
(BS006) reconstitué. Homogénéiser.
- Chauffer le produit à analyser afin de détruire les formes végétatives et d’activer les spores.
- Transférer 1 mL de l’inoculum et de ses dilutions décimales dans les tubes en évitant au
maximum d’incorporer de l’air au milieu.
- Homogénéiser parfaitement.
- Refroidir dans un bain d’eau glacée.
- Incuber à 46°C ou bien à 37°C pendant 20-24 heures, suivant le protocole analytique utilisé.
NOTA :
Le chauffage des tubes après ensemencement doit être évité.
UTILISATION EN BOITES ø 90 mm (Milieu de base + D-cyclosérine)
- Pour 100 mL de milieu de base, ajouter stérilement 1,0 mL de supplément sélectif D-
cyclosérine 200 mg reconstitué (BS006). Homogénéiser.
- Transférer 1 mL de l’inoculum et de ses dilutions décimales dans les boîtes.
- Couler 15 à 20 mL de milieu complet.
- Homogénéiser parfaitement.
- Laisser solidifier sur une surface plane.
- Les boîtes inoculées doivent être incubées en jarre d’anaérobiose pendant 24 heures à 37°C
en présence d’un mélange gazeux d’hydrogène et de dioxyde de carbone.
- La lecture sera effectuée aussitôt après l'ouverture de la jarre, sinon les colonies risquent de
pâlir par suite de l’oxydation du sulfure de fer.
- Faire les tests de confirmation nécessaires à l'identification de Clostridium perfringens :
coloration de Gram, catalase, test de réduction des nitrates, mobilité, hydrolyse de la gélatine,
subcultures sur bouillon Lactose-Sulfite (LS) (BK140), etc...
Milieu de base + D-cyclosérine + jaune d’oeuf
Pour mettre en évidence la lécithinase produite par Clostridium perfringens, le milieu peut être
additionné d’une émulsion stérile de jaune d’oeuf (BS066) à raison de 8 mL pour 100 mL de
milieu de base fondu, ramené à 44-47°C.
UTILISATION EN BOITES ø 55 mm (Milieu de base sans D-cyclosérine)
Pour le contrôle des eaux par la méthode de filtration sur membrane
- Couler une première couche d’environ 2 mm de milieu dans les boîtes.
- Laisser solidifier sur une surface froide.
- Chauffer l’inoculum afin de détruire les formes végétatives et d’activer les spores.
- Filtrer la quantité d’eau appropriée.
- Déposer la membrane dans la boîte, face supérieure tournée vers le bas, en s’assurant qu’il
ne reste pas de bulles d’air emprisonnées sous le filtre.
- Couler une deuxième couche de gélose dans les plus brefs délais, de façon à porter
l’épaisseur totale de gélose à 5 mm environ.
- Laisser solidifier sur une surface froide.
- Incuber en conditions anaérobies pendant 20 et 44 heures à 37°C.

3/6
Biokar Diagnostics – Rue des Quarante Mines – ZAC de Ther – Allonne – B.P. 10245 – F60002 Beauvais Cedex – France
Tél : + 33 (0) 3 44 14 33 33 – Fax : +33 (0) 3 44 14 33 34 – www.biokar-diagnostics.fr
LECTURE
Dénombrer les colonies entourées d’un halo noir. Lorsqu’elles sont cultivées en présence de
jaune d’oeuf, les colonies de Clostridium perfringens sont entourées d’une auréole opaque due à
la production de lécithinase.
FORMULE-TYPE du milieu complet (avec D-cyclosérine)
(pouvant être ajustée de façon à obtenir des performances optimales)
Pour 1 litre de milieu :
- Tryptone.........................................................................................15,0 g
- Peptone papaïnique de soja............................................................5,0 g
- Extrait autolytique de levure ............................................................5,0 g
- Métabisulfite de sodium...................................................................1,0 g
- Citrate ferrique ammoniacal.............................................................1,0 g
- D-cyclosérine...................................................................................0,4 g
- Agar agar bactériologique..............................................................15,0 g
pH du milieu prêt-à-l’emploi à 25°C : 7,6 ± 0,2.
CONTRÔLE QUALITE
- Milieu de base déshydraté : poudre beige, fluide et homogène.
- Milieu préparé (complet) : gélose ambrée.
- Réponse culturale de croissance (TSC complet avec D-cyclosérine) après 20 heures
d’incubation en anaérobiose à 37°C, en boîtes de Petri (XP CEN ISO/TS 11133-2) :
Microorganismes Croissance
(Rapport de productivité) Caractéristiques
Clostridium perfringens ATCC® 13124
Clostridium perfringens NCTC 8238
Escherichia coli ATCC 25922
PR ≥ 50%
PR ≥ 50%
inhibée
colonies noires
colonies noires
- Réponse culturale de croissance (TSC complet avec D-cyclosérine) après 24 heures
d’incubation en anaérobiose à 36°C, en tubes (NF T 90-415) :
Microorganismes Croissance
(Rapport de productivité) Caractéristiques
Clostridium perfringens ATCC® 13124
Escherichia coli RIVM WR1
66% ≤ R3 ≤ 150%
inhibée colonies noires

4/6
Biokar Diagnostics – Rue des Quarante Mines – ZAC de Ther – Allonne – B.P. 10245 – F60002 Beauvais Cedex – France
Tél : + 33 (0) 3 44 14 33 33 – Fax : +33 (0) 3 44 14 33 34 – www.biokar-diagnostics.fr
- Réponse culturale de croissance (TSC sans D-cyclosérine) après 20 heures d’incubation en
anaérobiose à 37°C (NF EN 26461-2 ; NF T 90-461) :
Microorganismes Croissance
(Rapport de productivité) Caractéristiques
Clostridium perfringens ATCC® 13124
Escherichia coli RIVM WR1
66% ≤ R3 ≤ 150%
inhibée colonies noires
STOCKAGE / CONSERVATION
Milieu de base déshydraté (sans D-cyclosérine) : 2-30°C.
- La date de péremption est mentionnée sur l’étiquette.
- Milieu de base préparé en flacons : 6 mois à 2-8°C (à titre indicatif) .
- Milieu complet préparé, avec supplément : utiliser immédiatement après préparation (à titre
indicatif).
Supplément sélectif D-cyclosérine 200 mg,
Emulsion stérile de jaune d’œuf,
Milieu prêt-à-liquéfier (base sans D-cyclosérine) :
- Stocker entre 2 et 8°C, à l’abri de la lumière.
- Les dates de péremption sont mentionnées sur les étiquettes.
PRESENTATION Code
Milieux prêts-à-liquéfier (base sans D-cyclosérine)
- Pack de 10 flacons de 200 mL BM07708
- Coffret de 50 tubes de 20 mL BM03908
Milieu de base déshydraté (sans D-cyclosérine) :
- Flacon de 500 g BK031HA
Supplément sélectif D-cyclosérine 200 mg :
- Coffret de 10 flacons qsp 500 mL BS00608
Emulsion stérile de jaune d’oeuf :
- Pack de 10 flacons de 50 mL BS06608

5/6
Biokar Diagnostics – Rue des Quarante Mines – ZAC de Ther – Allonne – B.P. 10245 – F60002 Beauvais Cedex – France
Tél : + 33 (0) 3 44 14 33 33 – Fax : +33 (0) 3 44 14 33 34 – www.biokar-diagnostics.fr
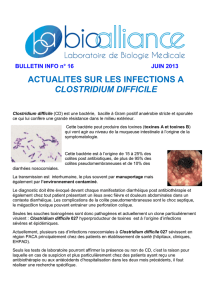
SUPPORT PHOTO :
Référence : [BK031HA + BS00608], BM03908, BM07708
Domaine d’utilisation : Isolement et dénombrement de Clostridium perfringens.
Gélose TSC
(utilisation en boîtes de Petri ∅ 90 mm)
Réf : BK031HA + BS00608
Incubation 24 heures à 37°C (anaérobiose)
Colonies caractéristiques noires parfois entourées d’un halo ou précipité noir
(réduction du sulfite de sodium)
Clostridium perfringens
Colonie caractéristique
Couleur noire, parfois
entourée d’un halo ou
précipité noir
 6
6
1
/
6
100%