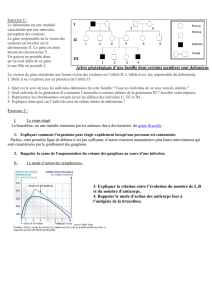
L `empreinte génomique parentale - iPubli

'empreinte génomique parentale
n ° 1, vol. 8, janvr
1 )

3 4 5 6
1

A
8
Zygote
1
A 8
2.

1
1' 1
1
!).

RÉFÉRENCES
°
 6
6
1
/
6
100%