Etat d`équilibre d`un système

Chapitre 5 : État d’équilibre d’un système
CONDUCTIMETRIE
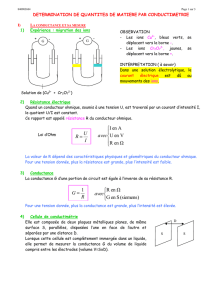
• La conductance G d’une solution comprise entre deux plaques conductrices parallèles de surfaces S et distantes
de l est proportionnelle à S et inversement proportionnelle à l
G = σ
σσ
σ . S
l
• La conductivité σ
σσ
σ d'une solution électrolytique est liée à la
conductance G d'une portion de cette solution par la relation :
σ
σσ
σ = k.G (voir les systèmes d’unités cohérents dans le tableau
ci-dessus)
• La conductivité est indépendante du système de mesure et ne dépend que des caractéristiques de la solution
(nature, concentrations des ions et température).
• La conductivité d'une solution électrolytique peu concentrée, constituée de p ions monochargés Xi (i variant de 1
à p), de concentrations [Xi] et de conductivités molaires ioniques λ
λλ
λi , est donnée par la relation :
σ
σ σ
σ = ∑
=
p
i1
λ
λλ
λi . [Xi]
Unités S.I. : σ
σσ
σ est exprimée en S • m-1 ; λ
λλ
λi en S . m2 . mol-1 ; [Xi] en mol . m-3.
• La conductivité d’une solution peut être mesurée à l’aide d’un conductimètre : celui-ci mesure la valeur de la
conductance de la solution entre ses électrodes et il faut l’étalonner à l’aide d’une solution étalon, de conductivité
connue (déterminer la constante de cellule k) pour en déduire la conductivité de la solution.
QUOTIENT DE REACTION
• On considère un système chimique en solution aqueuse, susceptible de subir une transformation modélisée la
réaction d'équation : a A (aq) + b B (aq) = c C (aq) + d D (aq).
Dans un état donné du système, le quotient de réaction est un nombre sans dimension, qui s'écrit :
Qr = [C]c . [D]d
[A]a . [B]b
• S'il est réactif, le solvant eau est représenté par le chiffre 1 dans l'expression du quotient de réaction.
• Dans le cas d'un système hétérogène mettant en jeu une solution aqueuse et des solides, les solides sont
représentés également par le chiffre 1 dans le quotient de réaction.
CONSTANTE D'EQUILIBRE
• À chaque équation de réaction, on associe une constante d'équilibre K, qui ne dépend que de la température.
• À l'équilibre et uniquement à l'équilibre, on a la relation:
Q r , éq =K
• La constante d'équilibre associée à une transformation totale a une
valeur élevée (K> 1 • 104).
Taux d'avancement final d'une réaction
• Pour une transformation donnée, le taux d'avancement final dépend
de la constante d'équilibre et de l'état initial du système chimique.
Grandeur Unités S.I. Unités
usuelles
Conductance G
Siemen (S) Siemen (S)
Surface S m² cm²
Distance L m cm
Conductivité σ
σσ
σ S.m-1 S.cm-1
COMPETENCES EXIGIBLES
- Utiliser la relation liant la conductance G aux
concentrations molaires effectives [Xi] des ions Xi en
solution.
- Savoir que, lorsque l’état d’équilibre du système est
atteint, les quantités de matière n’évoluent plus, et que cet
état d’équilibre est dynamique.
- En disposant de l’équation d’une réaction, donner
l’expression littérale du quotient de réaction Qr.
- Savoir que le quotient de réaction dans l’état d’équilibre
d’un système, Qr, éq, prend une valeur, indépendante de
la composition initiale, qui est la constante d’équilibre
associée à l’équation de la réaction.
- Savoir que, pour une transformation donnée, le taux
d’avancement final dépend de la constante d’équilibre et
de l’état initial du système.
1
/
1
100%