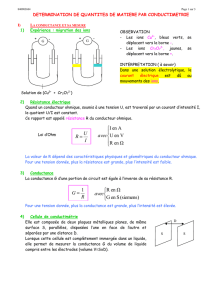
La conductance

CONDUCTANCE
ET
CONDUCTIVITE

1) Qu’est-ce que la
conductance ?
La conductance d’une solution , ou d’un conducteur
quelconque est l’inverse de sa résistance électrique
G = 1/R Unité le siemens S ( R en
ohm)

2) De quoi dépend la
conductance d’une
solution
A.Des caractéristiques de
l’électrode de mesure
B. Des caractéristiques de la
solution

A1De la distance entre
les électrodes
La conductance diminue de moitié quand la
distance l entre les deux électrodes (violette et
verte) est doublée

A2De la surface des deux
électrodes en contact avec le
liquide
La conductance est doublée quand S est
doublée
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%