NAc - PsychoACTIF

1
Psychopharmacologie
de la toxicomanie
modes d’action des drogues
Dr. S. Bartolami
Faculté des Sciences
INSERM U1051 Hôpital St Eloi Montpellier
2015
Usage régulier : (minimum) alcool 3 fois /semaine, tabac quotidien,
cannabis 10 fois / mois

2
«
««
« Addictus
AddictusAddictus
Addictus »
»»
»
homme libre devenu esclave
homme libre devenu esclavehomme libre devenu esclave
homme libre devenu esclave
Chapitre 1:
Chapitre 1:Chapitre 1:
Chapitre 1:
Le syst
Le systLe syst
Le systè
èè
ème de la
me de la me de la
me de la
motivation et de
motivation et de motivation et de
motivation et de
l
ll
l’
’’
’aversion
aversionaversion
aversion
Le syst
Le systLe syst
Le systè
èè
ème c
me cme c
me cé
éé
ér
rr
ré
éé
ébral de la motivation :
bral de la motivation : bral de la motivation :
bral de la motivation :
Le circuit du renforcement ou de la récompense
R
RR
Ré
éé
éseau de structures nerveuses
seau de structures nerveusesseau de structures nerveuses
seau de structures nerveuses
Sensations agr
Sensations agrSensations agr
Sensations agré
éé
éables et d
ables et dables et d
ables et dé
éé
ésagr
sagrsagr
sagré
éé
éables
ablesables
ables
Actions b
Actions bActions b
Actions bé
éé
én
nn
né
éé
éfiques /Actions pr
fiques /Actions prfiques /Actions pr
fiques /Actions pré
éé
éjudiciables
judiciablesjudiciables
judiciables

3
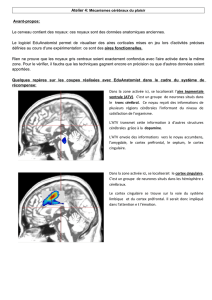
I – L’innervation
dopaminergique cérébrale
1) Les récepteurs de la dopamine
2 classes de récepteurs métabotropiques
D1-like (D1 et D5)
l'adénylate cyclase (AC)
D2-like (D2, D3, D4)
l'adénylate cyclase (AC)
Excitation du neurone

4
2 noyaux dopaminergiques
du mésencéphale : la
substance noire et l’aire
tegmentale ventrale (ATV)
2) Le faisceau mésocorticolimbique
•ATV innerve:
surtout le cortex frontal (cognition et la motricité)
le système limbique (affectivité)
le noyau accumbens NAc (motivation et l’aversion)
Cet ensemble
constitue le faisceau
mésocortiocolimbique
ATV
NAc

5
L’innervation DAergique mésocorticolimbique contribue au
circuit de la
récompense/renforcement très forte stimulation encéphalique
éprouver du plaisir (action hédonique) lors de comportements
essentiels à la survie de l’individu ou de l’espèce.
Le plaisir incite à réitérer le comportement : c’est le renforcement
Ce circuit de motivation est
Ce circuit de motivation est Ce circuit de motivation est
Ce circuit de motivation est d
dd
dé
éé
étourn
tourntourn
tourné
éé
é par les drogues
par les droguespar les drogues
par les drogues.
..
.
Les drogues
Les drogues Les drogues
Les drogues
plaisir
plaisir plaisir
plaisir
motive l
motive lmotive l
motive l’
’’
’individu
individu individu
individu à
àà
à adopter un
adopter un adopter un
adopter un
comportement compulsif o
comportement compulsif ocomportement compulsif o
comportement compulsif où
ùù
ù l
ll
l’
’’
’usage de la drogue remplace les
usage de la drogue remplace les usage de la drogue remplace les
usage de la drogue remplace les
comportements de survie.
comportements de survie.comportements de survie.
comportements de survie.
L
LL
L’
’’
’usage compulsif produit la d
usage compulsif produit la dusage compulsif produit la d
usage compulsif produit la dé
éé
épendance
pendance pendance
pendance
la toxicomanie est
la toxicomanie est la toxicomanie est
la toxicomanie est
install
installinstall
installé
éé
ée
ee
e
II- Le circuit du renforcement ou de la récompense
Motivation et Aversion
2) Eviter les comportements néfastes1) Favoriser les comportements
bénéfiques
Plaisir
Renforcement
Malaise, dégout
Abolition
Survie et d
Survie et dSurvie et d
Survie et dé
éé
éveloppement
veloppementveloppement
veloppement
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
1
/
53
100%