Biologie Moléculaire du Gène

Biologie Moléculaire du Gène
Dr. Cyril GUEYDAN, [email protected]
Prof. Véronique KRUYS, [email protected]
Site web du laboratoire: http://www.ulb.ac.be/rech/inventaire/unites/ULB130.html
Localisation : IBMM, rue des Prof. Jeener et Brachet 12, B 6041 Gosselies
tél. 02/650 9802 ou 650 9804 ou 05 fax 02/650 9800
Thèmes de recherche
Régulation de l’expression des gènes impliqués dans la réponse immunitaire innée.
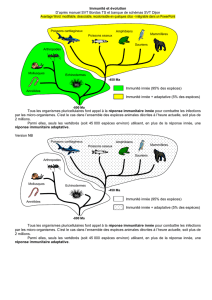
Le système immunitaire des mammifères est classiquement subdivisé en deux branches, baptisées
immunité innée et immunité acquise. L’immunité innée représente la première ligne de défense de
l’organisme contre les infections. Ce système est formé par des cellules constitutivement présentes
dans l’organisme et qui sont rapidement recrutées sur le site d’infection. Au contact des pathogènes,
ces cellules produisent des cytokines. Ces protéines sécrétées ont de multiples fonctions. Elles
participent à l’élimination des pathogènes et des cellules infectées mais permettent également aux
cellules du système immunitaire de communiquer entre elles pour réguler la réponse innée ou mettre
en place la réponse immunitaire acquise (deuxième ligne de défense).
La régulation de la production des cytokines par les cellules du système immunitaire est d’une
importance capitale pour le bon fonctionnement de la réponse immune. En effet, une production
tardive ou insuffisante de ces protéines peut diminuer l’efficacité de la réponse immune. A l’opposé,
une production trop élevée de cytokines engendre une toxicité importante dans l’organisme.
Dans de nombreux cas, la production de cytokines est régulée au niveau post-transcriptionnel grâce à
une séquence riche en adénine et uridine (appelée ARE pour AU-rich element) présente dans la partie
non-traduite des ARNs messagers de ces cytokines. Ces AREs modulent à la fois la stabilité et la
traductibilité des ARNm qui les portent. Ce mode de régulation basé sur la disponibilité de l’ARN
messager vis-à-vis de la machinerie de traduction (contrôle post-transcriptionnel) plutôt que sur la
synthèse de l’ARNm (contrôle transcriptionnel), permet à la cellule de produire rapidement une
protéine dans des conditions ou celle-ci est utile et de bloquer efficacement sa production dans le cas
où celle-ci peut s’avérer néfaste.
Projets de recherche
Le laboratoire étudie depuis plusieurs années le fonctionnement des AREs au niveau moléculaire. Nos
travaux et ceux d’autres groupes ont permis de caractériser un ensemble de protéines qui se fixent à
ces séquences et permettent de réguler leur fonction. Toutefois, les mécanismes par lesquels
l’environnement cellulaire influence le fonctionnement des AREs restent à ce jour très mal connu.
Ces travaux sont compliqués par la redondance et l’interconnection des différentes voies de
signalisation qui contrôlent l’immunité innée dans les cellules de mammifères. La drosophile
(Drosophila melanogaster) ne possède pas d’immunité acquise. Ses défenses immunitaires s’articulent
toutes autour d’un système d’immunité innée. En particulier, les Haemocytes sont des cellules qui
chez la drosophile vont reconnaître les pathogènes et sécréter en retour des peptides toxiques pour ces
pathogènes (peptides anti-bactériens et anti-fongiques).
Les hémocytes de drosophile constituent un très bon modèle d’étude ex vivo. En effet, une lignée
immortalisée de cellules hémocytaires (cellules S2) se cultive facilement in vitro. De plus,
l’expression des gènes de cellules S2 peut très facilement être modulée de manière exogène par des
ARN interférents (RNAi). Il a été démontré que les cellules S2 sont stimulables par des extraits
bactériens de manière à mimer une infection et induire la synthèse des peptides de défense.

Récemment, nous avons observé que l’expression du peptide anti-microbien, la cecropin A1 (cec A1)
est régulée par un mécanisme post-transcriptionnel faisant intervenir une séquence ARE.
Nos projets actuels visent à caractériser ce mode de régulation en cellules de Drosophile pour par la
suite faciliter sa compréhension chez les mammifères (souris, homme).
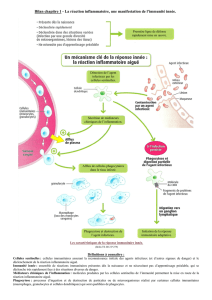
Des recherches menées en collaboration avec le laboratoire d’immunobiologie (Prof. O. Leo) ont mis
en évidence l’importance d’une famille de protéines appelées sirtuines dans le contrôle de la réponse
immunitaire innée. Les sirtuines sont des protéines de la famille des déacétylases. Il a été montré que
l’inhibition de ces enzymes par différents agents pharmacologiques interfère avec la mise en place de
voies de signalisation intracellulaires conduisant à la production de cytokines pro-inflammatoires
(TNF-α) par les cellules du système immunitaire inné des mammifères et de peptides anti-microbiens
par des hémocytes de Drosophile. Ces résultats suggèrent que la modification post-traductionnelle,
par acétylation/deacétylation, de différentes protéines joue un rôle essentiel lors de la transduction des
signaux nécessaires à la mise en place de la réponse immune. Avec le laboratoire d’immunobiologie,
nous poursuivons l’identification des sirtuines et de leurs cibles dans le contexte de la réponse immune
innée de mammifères et de drosophile.
Les travaux de mémoires proposés par le laboratoire seront intégrés aux deux sujets de recherche
présentés ci-dessus.
Publications récentes
- Identification of the sequence determinants mediating the nucleo-cytoplasmic shuttling of TIAR/TIA-1
RNA-binding proteins. T. Zhang, N. Delestienne, G. Huez, C. Gueydan and V. Kruys. J. Cell Sci. (2005) 118,
5453-5463.
- Identification of FUSE-binding proteins as interacting partners of the ARE-binding proteins TIAR and
TIA-1. F. Rothé, C. Gueydan, E. Bellefroid, G. Huez, V. Kruys. Bioch. Biophys. Res. Comm. (2006) 343, 57-
68.
- The cold-induced RNA-binding protein migrates from the nucleus to cytoplasmic stress granules by a
methylation-dependent mechanism and acts as a translational repressor. F. De Leeuw, T. Zhang, C. Wauquier,
G. Huez, V. Kruys and C. Gueydan. Exp. Cell Res. (2007) 313, 4130-4144.
- Intracellular NAD levels regulate TNF-α protein synthesis in a sirtiun-dependent manner. F. Van Gool, M.
Galli, C. Gueydan, V. Kruys, P.-P. Prévot, A. Bedalov, R. Mostoslavsky, F. Alt, T. De Smedt and O. Leo.
Nature Medicine (2009) 15, 206-210.
- Post-transcriptional regulation of genes encoding anti-microbial peptides in drosophila. A. Lauwers, L.
Twyffels, R. Soin, C. Wauquier, V. Kruys and C. Gueydan. J. Biol. Chem. (2009) 284, 8973-8983.
- The splicing factor ASF/SF2 is associated to TIAR/TIA-1-containing ribonucleoproteic complexes and
contributes to post-transcriptional repression of gene expression. N. Delestienne, C. Wauquier, R. Soin, J.-F.
Dierick, C. Gueydan and V. Kruys. FEBS J. (2010) 277, 2496-2514.
- Impaired embryonic development in mice overexpressing the RNA-binding protein TIAR. Y. Kharraz, P.-A.
Salmand, A. Camus, J. Auriol, C. Gueydan, V. Kruys, and D. Morello. PLoS ONE (2010) 5(6) e11352.
- The HTLV-1 Tax protein inhibits formation of stress granules by interacting with histone deacetylase 6
(HDAC6). S. Legros, M. Boxus, JS. Gatot, C. Van Lint, V. Kruys, R. Kettman, JC. Twizere, and F. Dequiedt.
Oncogene (2011) 30, 4050-4062.
- SR proteins: more than splicing factors. L Twyffels, C. Gueydan, and V. Kruys. FEBS Journal (2011) 278,
3246-3255
1
/
2
100%