Synthèse de l'aniline : Rapport de laboratoire de chimie organique

TP de Chimie Organique
Fournier Coralie
Assistante : Francesca Giacomina 22 février 2010
N°30 Aniline
- 1 -
SYNTHÈSE DE L’ANILINE PAR
RÉDUCTION DU NITROBENZÈNE

TP de Chimie Organique
Fournier Coralie
Assistante : Francesca Giacomina 22 février 2010
N°30 Aniline
- 2 -
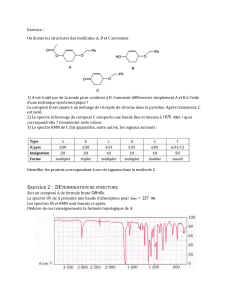
1. Introduction
1.1 But du projet
Le but de cette expérience est de synthétiser de l’aniline par réduction du nitrobenzène.
L’aniline est utile pour teindre et est souvent à la base de plusieurs médicaments, herbicides, agents
colorants ou encore utilisé à la base de la synthèse du caoutchouc.
L’aniline doit être manipulée avec précaution car elle est très toxique et classée comme
cancérigène.
1.2 Schéma de la réaction
L’aniline est synthétisée par réduction du nitrobenzène. Pour permettre la réduction du nitrobenzène il
faut fournir un apport d’électrons. Ces derniers sont fournis par l’oxydation de l’étain avec l’acide :
€
Sn +2HCl " → " SnCl2+2H++2e−
SnCl2+2HCl " → " SnCl4+2H++2e−
Ce qui permettra d’obtenir l’aniline par réduction du benzène d’après la réaction :
€
C6H5NO2+6H++6e−# → # C6H5NH2+2H2O
L’étain est éliminé par ajout d’une base ce qui permet de créer un complexe.
€
SnCl4+4NaOH " → " Sn(OH)4+4NaCl
Le mécanisme de la réaction est le suivant :
N
O O
e
N
O O
H
N
O OH
H
N
HO OH
-H
-H2O
N
O
e
N
O
H
HN
O
2H
HN
OH2
e-H2O
NH
H
NH2

TP de Chimie Organique
Fournier Coralie
Assistante : Francesca Giacomina 22 février 2010
N°30 Aniline
- 3 -
2. Déroulement de la synthèse
10.3 mL de nitrobenzène et 22.14 g d’étain sont placés dans un ballon tricols de 250 mL. Le ballon est
placé dans un bain de glace, car la réaction sera exothermique lors de l’ajout de l’acide. 50 mL d’acide
chlorhydrique sont ajoutés par pas de 5 mL et cela durant 20 minutes. Lorsque tout l’acide est ajouté et que la
solution est stable, le tout est chauffé à environs 100 °C pendant 30 minutes.
Le mélange est refroidit et un solide jaune pâle se forme. Une solution de NaOH (0.6 g/mL) est
ajoutée lentement est le solide se dissout entièrement. La solution prend alors une apparence opaque et est
de couleur brune-grise.
Un appareillage pour entraînement à la vapeur est installé et le produit est distillé. Grâce à se
montage l’aniline sera distillée en même temps que l’eau et cela à une température de vapeur indiquée à 80
°C. La distillation est effectuée jusqu’à obtenir un distillat d’environs 60 mL.
Le distillat est alors saturé avec du NaCl et el tout est extrait avec 3 portions d’éther. Les phases
organiques sont réunies et séchée à l’aide du K2CO3. L’éther est évaporé à l’aide du rotavapor et le produit est
distillé sous vide. Le vide n’était pas très bon et la distillation à prise énormément de temps.
3. Résultats et discussions
3.1 Rendement
Le rendement théorique pour cette synthèse s’élève à environs 89%.
Lors de cette expérience, 3.47 g de produit sont obtenus. Le rapport de la synthèse étant de 1 :1,
nous observons les calculs suivants :
€
nnitrobenzène =naniline =mnitrobenzène
MMnitrobenzène
=12.4115
123.1 =0.1008 mol
et la masse de produit théorique à obtenir s’élève à :
€
mthéorique =naniline ⋅MManiline =0.1008 ⋅93.1265 =9.39 g
et le rendement obtenu est :
€
η
=mobtenu
mthéorique
=3.47
9.39 =36.95%
Le rendement de cette synthèse est nettement moins bon que celui auquel nous nous attendions,
Cela est certainement du à la perte de produit lors des transfert de ballon et principalement à la distillation
sous vide finale qui n’a pas fonctionné de manière optimale.
3.2 Analyse spectre RMN
La pureté du produit synthétisé peut être observée grâce au spectre RMN. Le spectre RMN obtenu
par expérience est de même allure que le spectre RMN attendu par SDBS.
Nous observons un premier pic à 3.71 qui correspond aux deux protons du groupement amine.
Plus loin dans le spectre, car plus déblindés, nous observons 3 pics principaux, correspondant aux
protons aromatiques. Le premier situé entre 6.79-6.77 correspond aux Hc (noté sur le spectre), ces deux
protons sont identiques et ils sont les moins déblindés car il ne possède qu0un seul proton voisin.

TP de Chimie Organique
Fournier Coralie
Assistante : Francesca Giacomina 22 février 2010
N°30 Aniline
- 4 -
Le deuxième pic situé entre 6.94-6.89 correspond au Hb et le dernier pic encore plus déblindé situé
entre 7.33-7.29 correspond au Ha.
Seul un autre pic situé à 2.25 est présent sur le spectre, il correspond certainement à un reste de
graisse. Le produit synthétisé est donc relativement pur.
3.3 Analyse spectre IR
L’analyse du spectre IR nous permet de contrôler si le produit attendu à bien été synthétiser et s’il ne
reste plus de produit de départ.
Ci-dessous un tableau répertoriant les pics attendus par la littérature et ceux relevés sur le spectre IR
de l’expérience.
Tableau N°1 : Pics IR
Pics littérature IR (huile, cm-1)
Pics IR (huile, cm-1)
3448
-
3355
3312
3226
3207
3076
-
3049
3026
1618
1619
1608
1601
1497
1497
1288
1282
1176
1165
1029
1027
998
995
880
881
752
744
692
692
La plupart des pics attendus sont retrouvés sur le spectre expérimental. De plus nous remarquons que
le produit de départ n’est plus présent dans l’échantillon. En effet le pic caractéristique du groupement NO2 se
situe à 1570-1510 et sur le spectre aucun pic n’est présent entre 1601 et 1497.
De plus, les pics pour les amines primaires se situent généralement entre 1650 et 1550 et nous
observons deux pics dans cette zone (1619 et 1601).
4. Conclusion
Nous obtenons un rendement très moyen pour cette expérience. Mais l’analyse des spectres RMN et
IR montre que le produit attendu, l’aniline, a bien été synthétisé et qu’il est relativement pur.

TP de Chimie Organique
Fournier Coralie
Assistante : Francesca Giacomina 22 février 2010
N°30 Aniline
- 5 -
5. Annexes
• Fiche de toxicité
• Spectre RMN
• Spectre IR
• Spectres SDBS
6. Sources bibliographiques
[1] Vollhart,Schore, « Traité de chimie organique », (1999)
1
/
5
100%