N°3 - Lycée Victor Hugo

PC –Lycée Victor Hugo
BESANCON
COLLES DE CHIMIE
SEMAINE 3 DU 03/10 au 08/10
Révisions de SUP : Classification périodique des éléments et électronégativité
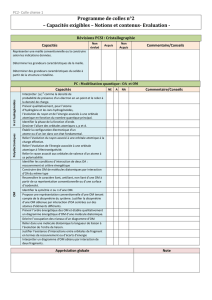
Notions et contenus
Capacités exigibles
États physiques et transformations de la
matière
Isotopes, abondance isotopique, stabilité.
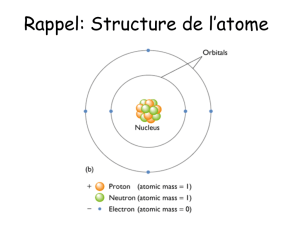
Ordres de grandeur de la taille d’un atome, des
masses et des charges de l’électron et du noyau.
Nombres quantiques n, l, ml et ms
Configuration électronique d’un atome et d’un ion
monoatomique.
Électrons de cœur et de valence.
Classification périodique des éléments
Architecture et lecture du tableau périodique
Électronégativité
Rayon atomique
Rayon ionique
Utiliser un vocabulaire précis : élément, atome,
corps simple, espèce chimique, entité chimique.
Établir un diagramme qualitatif des niveaux
d’énergie électroniques d'un atome donné.
Établir la configuration électronique d’un atome
dans son état fondamental (la connaissance des
exceptions à la règle de Klechkowski n’est pas
exigible).
Déterminer le nombre d’électrons non appariés
d’un atome dans son état fondamental.
Prévoir la formule des ions monoatomiques d’un
élément.
Relier le caractère oxydant ou réducteur d’un
corps simple à l’électronégativité de l’élément.
Comparer l’électronégativité de deux éléments
Interpréter l’évolution du rayon atomique dans la
classification périodique en utilisant la notion
qualitative de nombre de charge effectif.
Interpréter la différence de valeur entre le rayon
d’un atome et le rayon de ses ions
PROGRAMME DE SPE
1. Orbitales atomiques
Etude de l’atome d’hydrogène
Fonctions d’onde, énergie et rayon associés. Spectres d’émission et d’absorption
Densité de probabilité de présence de l’électron
espèce hydrogénoïde : énergie associée à une orbitale atomique
Atomes polyélectroniques :
Orbitales des atomes polyélectroniques ;
Dessiner l’allure des orbitales atomiques s, p et d. Identifier la phase de la fonction d’onde, définition du
plan nodal. Représentation symbolique.
Établir la configuration électronique d’un atome ou d’un ion dans son état fondamental. Régles associées.
Électrons de cœur et de valence.
Notion qualitative de charge effective. Evolution sur une ligne de la classification sur une colonne en passant
d’un gaz rare d’une ligne à ‘alcalin de la ligne suivante.
Compétences attendues
o Relier l’évolution du rayon associé à une orbitale atomique à la charge effective.

o Relier l’évolution de l’énergie associée à une orbitale atomique à l’électronégativité.
o Relier le rayon associé aux orbitales de valence d’un atome à sa polarisabilité.
2. Structure électronique des molécules.
Méthode de Combinaison Linéaire des Orbitales Atomiques.
Description des molécules diatomiques homonucléaires : étude du dihydrogène et du dioxygème (idem pour F2) :
principe de construction des orbitales moléculaires par combinaison linéaire d'orbitales atomiques de même
symétrie ; notion de recouvrement de deux OA.
Compétences attendues pour ces trois molécules :
o Construire des orbitales moléculaires par interaction d’orbitales atomiques du même type (s-s, p- p).
o énergie d’une orbitale moléculaire : dans le diagramme, savoir placer qualitativement le niveau
énergétique de l’OM à partir du niveau énergétique des OA
o Reconnaître le caractère liant, antiliant, non liant d’une orbitale moléculaire ainsi que la symétrie
et
à partir de sa représentation conventionnelle ou d’une surface d’iso-densité.
o Remplissage électronique d’un diagramme d’orbitales moléculaires. Calcul de l’indice de liaison
Description des molécules diatomiques de type A-B sans interaction croisée : exemple de HF
Interaction d’orbitales de fragments : Interpréter un diagramme d’orbitales moléculaires obtenu par
interaction des orbitales de deux fragments, fournies
Prévision de la réactivité : approximation des orbitales frontalières.
Définitions des orbitales frontalières haute occupée HO et basse vacante BV,
Définition précise d’un électrophile et nucléophile sans aucune hésitation + citer des exemples
Utilisation de la théorie des orbitales frontalières pour prévoir la réactivité (régiosélectivité et réactivité
comparée)
Exemples : addition de H+ sur le propène régiosélectivité. Addition d’un organomagnésien sur un carbonyle
Comparaison de la réactivité : réactivité comparée de l’éthylène et du propène vis-à-vis de l’addition de H+
TP : Dosages pHmétriques
Selon :
Notions contenus
Capacités exigibles
Méthodes expérimentales de suivi d’un titrage
par pHmétrique
Application aux dosages des acides et dosages.
Identifier et exploiter la réaction support du titrage
recenser les espèces présentes dans le milieu au cours du
titrage
justifier qualitativement l’allure de la courbe.
Exploiter une courbe de titrage pour déterminer le titre
en espèce dosée.
Pour le dosage pHmétrique savoir choisir les électrodes
(pas de description détaillée pour le moment)
Les acides suivants doivent êtres connus
Nom, formule et nature – faible ou forte – des acides sulfurique, nitrique, chlorhydrique, phosphorique, acétique,
de la soude, la potasse, l’ion hydrogénocarbonate, l’ammoniac ;
1
/
2
100%