les maladies auto-inflammatoires

Fièvre méditerranéenne familiale
Syndromes périodiques associés à la cryopyrine (CAPS)
TRAPS : corrélation génotype/phénotype
et perspectives thérapeutiques
Syndromes associés à la mévalonate kinase (MAPS)
Ressources Internet pour l’étude
des maladies auto-inflammatoires
Maladie de Crohn et syndrome de Blau
Maladie de Behçet : une maladie auto-inflammatoire ?
Syndrome lymphoprolifératif
avec auto-immunité : un défaut hérité ou acquis
d’apoptose lymphocytaire
Les maladies
auto-inflammatoires
S. Guillaume, N. Mahlaoui, B. Neven, F. Rieux-Laucat, J. Sibilia
12
15
19
20
22
22
24
25
Dossier
thématique

La 4eJournée du CRI, consacrée aux pathologies auto-inflam-
matoires, s’est déroulée le 20 mai 2005 à l’Institut Pasteur,
à Paris. Elle a été l’occasion d’aborder ces pathologies qui
ont spectaculairement bénéficié des avancées de la génétique,
d’un point de vue à la fois clinique et physiopathologique.
Les maladies auto-inflammatoires comprennent les fièvres récur-
rentes héréditaires, qui seront décrites ici (fièvre méditerranéenne
familiale [FMF] ou maladie périodique, syndrome hyper-IgD,
syndromes périodiques associés au récepteur du TNF, syndromes
périodiques associés à la cryopyrine).
Chez l’enfant, deux diagnostics différentiels sont souvent évo-
qués devant une fièvre récurrente avec signes cutanéo-muqueux
et articulaires : la maladie de Still, dont la ou les causes sont encore
aujourd’hui inconnues, et le syndrome PFAPA, qui associe une
fièvre périodique, des aphtes, une pharyngite et des adénopathies
cervicales, et qui évolue spontanément vers la guérison. Ces affec-
tions n’ont pas été abordées au cours de cette journée.
Les maladies auto-inflammatoires regroupent aussi d’autres affec-
tions comme le syndrome de Blau, également appelé sarcoïdose
familiale, la maladie de Crohn, et très probablement d’autres affec-
tions proches de ces maladies granulomateuses, comme la mala-
die de Behçet.
D’autres affections, génétiquement déterminées, peuvent se carac-
tériser par des manifestations auto-immunes. Les syndromes auto-
immuns lymphoprolifératifs (ALPS) sont un des exemples les
plus démonstratifs.
FIÈVRE MÉDITERRANÉENNE FAMILIALE
Données actuelles sur la physiopathogénie de la FMF
D’après S. Amselem, Créteil, France
●
●Comment expliquer et diagnostiquer la FMF ? Les critères
diagnostiques
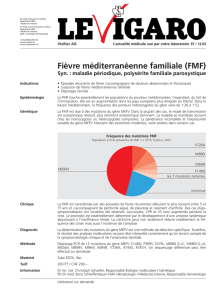
La FMF est la plus fréquente des maladies auto-inflammatoires
(tableau I). Il s’agit d’une maladie autosomique récessive qui
associe dans une population à risque (Arméniens, Turcs, Grecs,
Juifs séfarades, Maghrébins) des crises fébriles récurrentes avec
* Rapport de la 4
e
Journée du Club rhumatismes et inflammations (CRI),
section spécialisée de la Société française de rhumatologie.
Comité scientifique : A.M. Prieur, G. Grateau, J. Sibilia,
S. Amselem, X. Mariette.
1
Policlinique pédiatrique, hôpital Bicêtre, Le Kremlin-Bicêtre.
2
Service d’immuno-hématologie pédiatrique, hôpital Necker, Paris.
3
U429 Inserm, hôpital Necker, Paris.
4
Service de rhumatologie, CHU Hautepierre, Strasbourg.
douleurs aiguës abdominales (abdomen pseudo-chirurgical),
éventuellement pleurales par inflammation des séreuses, des
signes articulaires et des lésions cutanées érysipéloïdes des
membres inférieurs. La fièvre et les douleurs durent classique-
ment moins de trois jours et disparaissent spontanément. Ces
symptômes s’accompagnent d’un syndrome inflammatoire bio-
logique non spécifique qui peut persister entre les crises, expo-
sant le patient au risque d’amylose. L’expression clinique de la
maladie peut être très variable, allant du tableau complet décrit
précédemment à une fièvre récurrente isolée.
Jusqu’au clonage du gène en cause, les critères diagnostiques de
FMF étaient cliniques (tableau II). Deux consortiums, l’un
Les maladies auto-inflammatoires*
●S. Guillaume
1
, N. Mahlaoui
2
, B. Neven
2
, F. Rieux-Laucat
3
, J. Sibilia
4
Tableau I. FMF et pathologies auto-inflammatoires.
Fièvres récurrentes héréditaires Hérédité Gène
Fièvre méditerranéenne familiale (FMF) AR MEFV
Syndrome de Muckle-Wells (MWS)
Urticaire familiale au froid (FCU) AD CIAS1/PYPAF1
Syndrome CINCA
Syndrome TRAPS AD TNFR
Syndrome hyper-IgD AR MVK
Autres pathologies Hérédité Gène
Maladie de Crohn Multifactorielle NOD2
Syndrome de Blau AD NOD2
TRAPS :syndromes périodiques associés au récepteur du TNF ;
CINCA : syndrome infantile chronique neurologique, cutané et articulaire ;
AR : autosomique récessif ; AD : autosomique dominant.
Tableau II. Critères de Livneh et al., 1997.
Critères majeurs Fièvre
Péritonite généralisée
Pleurésie
Arthrite localisée
Atteinte abdominale incomplète
Critères mineurs Atteinte incomplète impliquant au moins le thorax
ou une articulation
Douleur à l’effort
Réponse à la colchicine
Diagnostic de FMF
au moins trois crises récurrentes du même type
présentant au moins un critère majeur
ou
au moins deux critères mineurs
La Lettre du Rhumatologue - n° 320 - mars 2006
12

La Lettre du Rhumatologue - n° 320 - mars 2006
13
israélo-américain et l’autre français, ont identifié en 1997 le même
gène MEFV par analyse de liaison génétique et clonage posi-
tionnel. Le gène MEFV, situé sur le bras court du chromosome
16, code pour une protéine appelée pyrine ou marénostrine, expri-
mée dans les polynucléaires neutrophiles et éosinophiles et dans
les monocytes activés. Elle est constituée de cinq domaines fonc-
tionnels. Toutes les mutations identifiées se situent dans l’un
d’entre eux, le domaine B30.2, dont la fonction est encore incon-
nue à l’heure actuelle.
●
●Peut-on utiliser l’analyse génétique pour établir le dia-
gnostic de FMF ?
L’équipe de S. Amselem a étudié 77 familles arméniennes indé-
pendantes, soit 90 patients ; en Arménie comme en Turquie, la
fréquence des porteurs hétérozygotes d’une mutation dans le gène
MEFV est en moyenne de 1 sur 5 et passe à 1 sur 10 dans les popu-
lations juives séfarades et arabes. Dans les familles étudiées, le
diagnostic de FMF a été porté sur les critères cliniques de Liv-
neh, et le gène MEFV a été séquencé sans analyse de liaison géné-
tique préalable. Dans 90 % des cas, les deux allèles du gène MEFV
étaient mutés. La valeur diagnostique du test génétique, considé-
rable dans la population arménienne, a été confirmée dans les
autres populations à risque. Cette étude a également permis de
comprendre ou d’identifier certains modes de transmission aty-
piques. Dans certaines familles, des cas de FMF étaient diagnos-
tiqués sur plusieurs générations, faisant croire à une transmission
dominante de la maladie. Les analyses génétiques ont pu mon-
trer que la transmission était bien autosomique récessive, mais
aussi pseudo-dominante, du fait de la fréquence des porteurs hété-
rozygotes dans les populations à risque. Par ailleurs, l’étude de
S.Amselem a montré que la pénétrance de la maladie était incom-
plète, puisque certains individus étaient porteurs de mutations de
MEFV sur les deux allèles sans être malades ; il existe donc des
facteurs modificateurs du phénotype.
●
●Quelle est la valeur pronostique des mutations du gène
MEFV ? Des “prédicteurs” du risque d’amylose AA ?
La deuxième question posée était celle de la valeur pronostique
de l’analyse génétique. S. Amselem a pu montrer que la mutation
homozygote M694V du gène MEFV s’accompagnait d’un risque
significativement plus élevé d’amylose et d’arthrite. Il a pu iden-
tifier des facteurs modificateurs du risque d’amylose, car les
patients ayant une mutation homozygote M694V ne font pas tous
une amylose ; d’autres génotypes se compliquent aussi d’amy-
lose, mais à un moindre degré. Ainsi, le sexe masculin et le géno-
type α/αdu gène SAA1, qui code pour la protéine amyloïde res-
ponsable de l’amylose, augmentent significativement le risque de
développer une amylose.
●
●Existe-t-il d’autres gènes que MEFV dans la FMF ?
Des analyses génétiques et statistiques ont également permis de
mettre en évidence une fréquence importante d’allèles non mutés
chez des malades atteints de FMF dans les populations à risque.
Des analyses de liaison génétique à la recherche d’autres gènes
impliqués dans la FMF, en particulier des gènes candidats comme
ceux qui codent pour des protéines appartenant à la même famille
que la pyrine/marénostrine, sont actuellement en cours. Enfin, il
a pu être montré que lorsque les mutations les plus fréquentes
avaient été éliminées, le séquençage de la totalité du gène MEFV
était inutile, car normal dans 85 à 99 % des cas.
●
●Comment faire le lien entre les mutations du gène MEFV
et d’éventuelles anomalies fonctionnelles de la pyrine-
marénostrine ? Rôle dans les mécanismes des “crises”
inflammatoires
Des études fonctionnelles ont permis de montrer que la pyrine/maré-
nostrine s’associait à une protéine appelée ASC par leurs domaines
pyrines respectifs. ASC possède également un domaine CARD (cas-
pase recruitment domain) capable de recruter des caspases, enzymes
impliquées dans l’apoptose et l’apprêtement de certaines cytokines.
Ainsi, ASC recrute la procaspase 1, dont l’accumulation provoque
l’autoactivation en caspase 1, capable de transformer la pro-IL-1β
en IL-1βactive et pro-inflammatoire qui sera sécrétée. L’accu-
mulation des protéines ASC, provoquée par certains stimuli comme
le stress ou les infections, induit aussi l’activation de la voie NFκB,
qui est une voie de signalisation cellulaire pro-inflammatoire et
anti-apoptotique (figure 1). Il a été montré que la marénostrine
normale inhibe la voie NFκB ainsi que la production d’IL-1β, exer-
çant un rétrocontrôle négatif, probablement en déviant ASC de
l’activation de la voie NFκB et de l’apprêtement de l’IL-1βet en
favorisant l’apoptose des cellules dans lesquelles elle est expri-
mée. Il a donc été suggéré que la mutation de MEFV sur les deux
allèles pourrait produire une marénostrine anormale, incapable de
jouer son rôle anti-inflammatoire, avec pour conséquence une
hypersécrétion d’IL-1β,une activation de la voie NFκB et une
réduction d’apoptose des cellules myéloïdes. Le stress ou les infec-
tions chez les patients atteints de FMF peuvent donc aboutir à une
réponse inflammatoire non contrôlée mettant en jeu différents
médiateurs comme l’IL-1, mais aussi d’autres cytokines, comme
le TNFαet l’IL-6.
Figure 1. ASC, inflammation et apoptose.
PYD CARD
ASC
CARD
Pro-
IL-1ß
IL-1ß
IL-1ß
Procaspase 1
Inactive
Caspase 1
Active
+
Apoptose
Activation
voie NFκB
Pourtant, la physiopathogénie des mutations de MEFV n’est tou-
jours pas comprise, et il existe un certain nombre d’arguments
mettant en doute leur pathogénicité :

DOSSIER THÉMATIQUE
La Lettre du Rhumatologue - n° 320 - mars 2006
14
●
●Premièrement, l’équipe de S. Amselem a pu montrer que, in
vitro, la marénostrine mutée dans son domaine B30.2 était toujours
capable d’inhiber la voie NFκB ainsi que la production d’IL-1β.
●
●Deuxièmement, les mutations observées chez les patients
atteints de FMF sont des mutations faux-sens qui aboutissent au
remplacement d’un acide aminé par un autre acide aminé le plus
souvent de même classe, faisant poser la question d’un polymor-
phisme plutôt que d’une mutation causale.
●
●Troisièmement, le séquençage de MEFV chez les primates sains
retrouve les mêmes mutations que chez les malades, mutations
qui correspondent donc chez les primates à des résidus normaux.
●
●Enfin, le domaine B30.2 n’est pas conservé dans l’espèce
murine, ce qui fait douter de l’importance de ce domaine dans le
fonctionnement normal de la protéine. Il est donc crucial de pour-
suivre des études fonctionnelles afin de mettre en évidence la res-
ponsabilité des mutations dans la pathogénie de la FMF. Les rela-
tions entre les anomalies génomiques (pourtant indiscutables) et
les mécanismes fonctionnels de la maladie sont un “casse-tête”
difficile à résoudre.
Manifestations cliniques de la FMF
D’après I. Koné-Paut, Le Kremlin-Bicêtre, France
●
●Quelles sont les principales manifestations cliniques ?
I. Koné-Paut a détaillé les différentes manifestations cliniques
évoquées précédemment, mettant l’accent sur les atypies qui peu-
vent être rencontrées en pratique clinique. L’un des premiers
points abordés a été la redéfinition de la population “à risque”,
puisqu’il semble que de nombreux patients atteints de FMF soient
également originaires du sud de l’Italie. Il est donc possible que
l’on découvre à l’avenir d’autres populations concernées par cette
maladie.
Dans la FMF, à l’interrogatoire, on découvre souvent des anté-
cédents familiaux de crises fébriles similaires. Les crises fébriles
sont inopinées et irrégulières, en termes tant de durée (classi-
quement de deux à trois jours) que de fréquence. La première
crise survient dans 90 % des cas avant 20 ans, en moyenne à l’âge
de 4 ans. La fièvre est habituellement élevée (39-40 °C) et
pseudo-palustre avec des frissons, l’enfant étant abattu et algique,
puis elle disparaît spontanément, avec un enfant qui redevient
parfaitement normal et asymptomatique. Les signes d’accom-
pagnement de la fièvre sont :
– Des douleurs abdomino-thoraciques du fait d’une polysérite
(rarement présente chez le très jeune enfant), avec parfois la
découverte d’une splénomégalie, fréquente chez les enfants dont
la maladie est mal contrôlée.
– Des douleurs articulaires, plus souvent à type de monoar-
thralgie que de véritable monoarthrite (pouvant être destructrice
chez l’adulte), touchant essentiellement la hanche, le genou ou
la cheville. Les arthralgies s’accompagnent souvent d’œdèmes
périarticulaires.
– Des myalgies d’effort fréquentes, déclenchées par l’endurance,
qui est donc déconseillée chez ces patients.
– Rarement, le malade peut se plaindre de myalgies fébriles pro-
longées sans anomalie à la biopsie musculaire.
– Les lésions cutanées, en particulier la plaque érysipélatoïde de
la cheville, du dos du pied ou de la région prétibiale, très carac-
téristique de la FMF. Il existe parfois une aphtose buccale ou une
éruption purpurique.
– Beaucoup plus rarement, il peut exister une méningite asep-
tique, une péricardite ou une orchite du fait de l’atteinte séreuse.
Enfin, une amylose AA est une complication tardive qui peut être
exceptionnellement révélatrice.
L’amylose AA est liée au dépôt de la protéine amyloïde AA dans
tous les vaisseaux, sauf au niveau cérébral. Celle-ci est produite en
grande quantité par certains patients.
L’amylose est-elle une complication de la FMF ou une maladie
associée à la FMF évoluant en parallèle ? La question reste aujour-
d’hui sans réponse définitive, mais il est bien possible que deux
gènes différents puissent être incriminés.
●
●Existe-t-il des associations avec d’autres affections ?
Dans 10 % des cas, la FMF s’associe à d’autres maladies comme
le purpura rhumatoïde, la périartérite noueuse, la maladie de Beh-
çet, ou une entéropathie inflammatoire. L’association à une spon-
dylarthropathie est considérée comme “classique”, bien que rare.
●
●Quels sont les principaux signes biologiques ?
En période fébrile,il existe un syndrome inflammatoire biolo-
gique qui peut persister entre les crises avec hyperleucocytose à
polynucléaires, une élévation de la vitesse de sédimentation (VS)
et de la protéine C réactive (CRP).
●
●Quel est le traitement ?
Le traitement des crises de la FMF comprend des anti-inflamma-
toires non stéroïdiens (AINS) et des antalgiques, les fortes doses
de colchicine n’ayant pas fait la preuve de leur efficacité et entraî-
nant des problèmes de tolérance majeurs. Le traitement préventif
des rechutes et de l’amylose fait appel à la colchicine à raison de
0,5 à 2 mg/j, indépendamment du poids du patient. L’efficacité de
la colchicine est totale dans 50 % des cas, partielle dans 25 % des
cas et nulle dans 25 % des cas. La plupart du temps, le défaut d’ef-
ficacité est lié à un problème de compliance. Parfois, l’adminis-
tration du traitement en deux prises orales quotidiennes permet
d’obtenir une efficacité satisfaisante. En cas de réelle résistance
au traitement oral, on peut administrer la colchicine par voie vei-
neuse à raison de 1 mg/sem., associée au traitement oral quotidien
habituel. L’expérience des traitements par IFNαet anti-TNF dans
cette indication est actuellement insuffisante. La colchicine est un
inhibiteur du chimiotactisme des polynucléaires. Sa tératogéni-
cité, prouvée in vitro, n’a pas été démontrée in vivo, et certaines
grossesses menées “accidentellement” sous colchicine ont permis
de donner naissance à des enfants normaux, mais ce traitement
reste, sauf exception, contre-indiqué pendant les grossesses. Un
tiers de la dose absorbée passe dans le lait maternel, ce qui ne le
contre-indique pas pendant l’allaitement. Enfin, la fertilité des
patients sous colchicine ne semble pas affectée.
Le traitement préventif de l’amylose est la prise quotidienne de col-
chicine, tandis que le traitement “curatif” fait appel aux immuno-
suppresseurs.
Les myalgies fébriles prolongées sont, quant à elles, sensibles à
une courte corticothérapie.

La Lettre du Rhumatologue - n° 320 - mars 2006
15
●
●Quels sont les critères diagnostiques ?
Le diagnostic clinique est posé sur les critères de Livneh
(tableau II). Il est conforté par la recherche des mutations fon-
datrices sur les deux allèles du gène MEFV par des techniques de
biologie moléculaire. La présence d’un seul allèle muté ou l’ab-
sence de mutation fondatrice n’excluent cependant pas le dia-
gnostic de FMF ; il est licite dans ce cas de tester la colchicine et
de rechercher en parallèle les diagnostics différentiels de la FMF
que sont les autres fièvres récurrentes (tableau III).
SYNDROMES PÉRIODIQUES ASSOCIÉS
À LA CRYOPYRINE (CAPS)
Syndrome de Muckle-Wells
D’après H. Lachmann, Londres, Grande-Bretagne
●
●Quels sont les signes cliniques ?
Le syndrome de Muckle-Wells (MWS) a été décrit pour la pre-
mière fois en 1962 à Londres. Il est caractérisé par la triade rash
urticarien-surdité-amylose AA chez un jeune enfant. D’autres
manifestations peuvent s’associer à cette triade, d’ordre ophtal-
mologique (épisclérite, conjonctivite, plus rarement uvéite), ostéo-
articulaire (arthralgies et arthrites, fréquentes chez l’enfant et
s’améliorant avec le temps, hippocratisme digital) et digestif
(douleurs abdominales). Ces manifestations évoluent par crises
de 3 à 4 jours ; la fièvre est parfois discrète, maximale en fin de
journée, et les patients décrivent souvent des symptômes géné-
raux tels que sensation de froid, frissons et fatigue. Il n’y a pas
de facteurs déclenchants précis aux épisodes inflammatoires.
●
●Quels sont les signes biologiques ?
Les épisodes critiques s’accompagnent biologiquement d’une
hyperleucocytose, d’un syndrome inflammatoire souvent majeur
– exacerbé au cours des poussées inflammatoires et persistant par-
fois entre les poussées – et d’une hypergammaglobulinémie poly-
clonale.
●
●Quel est le risque d’amylose AA ?
C’est la libération continue de protéines de la phase aiguë de l’in-
flammation (protéine SAA) qui est responsable de la survenue
d’une amylose touchant 25 % des patients atteints de MWS. L’ex-
pression clinique de cette amylose est essentiellement rénale,
conduisant environ 30 % des malades au stade d’insuffisance
rénale terminale. L’équipe de H. Lachmann a pu montrer sur
presque 200 patients que la charge amyloïde détectée en scinti-
graphie ainsi que la survie des malades dépendent étroitement du
taux de SAA circulant, avec un pourcentage de survie à 7 ans infé-
rieur à 50 % si le taux de SAA dépasse 50 mg/l, contre 90 % s’il
est maintenu en dessous de 10 mg/l.
●
●Quelles sont les anomalies génomiques associées à la mala-
die ? Des mutations du gène CIAS1
En fait, le MWS fait partie d’un spectre de maladies induites par
des mutations d’un seul et même gène situé sur le chromosome 1
et appelé CIAS1 (cold-induced autoinflammatory syndrome 1).
CIAS1 code pour une protéine cytoplasmique appelée NALP3 ou
cryopyrine, qui est fortement exprimée dans les polynucléaires
neutrophiles et les monocytes. Les maladies associées au gène
CIAS1 ont été appelées CAPS (cryopyrin associated periodic syn-
drome) et sont donc toutes transmises selon un mode autosomique
dominant.
Les mutations de CIAS1 engendrent trois types de maladies, allant
de la forme la plus bénigne : l’urticaire familial au froid (FCU),
à la forme la plus sévère : le syndrome CINCA (chronic infantile
neurologic cutaneous articular syndrome) ou NOMID (neonatal
Tableau III. Diagnostics différentiels de la FMF : les fièvres récurrentes.
FMF HIDS TRAPS CAPS, FCU CAPS, MWS CAPS, CINCA
Début des signes Petite enfance Néonatal Adolescence Néonatal Néonatal Néonatal
à âge adulte à âge adulte
Durée de la fièvre 3 jours 3-5 jours 21 jours Variable Variable Variable
Autres signes distinctifs Plaque érysipéloïde Déclenché Œdème périorbitaire Déclenché Surdité de perception Méningite
Splénomégalie par les vaccins Érythème centrifuge par le froid Amylose chronique
Amylose Adénopathies Myosite Urticaire atypique Dysmorphie
cervicales Amylose Hypertrophies
Céphalées épiphysaires
Amylose
FMF : fièvre méditerranéenne familiale ; HIDS : syndrome hyper-IgD ; CAPS : syndromes périodiques associés à CIAS1 ;
FCU : urticaire familiale au froid ; MWS : syndrome de Muckle-Wells ; néonatal : avant 6 mois.
Tableau IV. Spectre clinique des mutations du gène CIAS1.
Urticaire familiale Syndrome de CINCA
au froid Muckle-Wells
Déclenchement au froid Rash urticarien Rash sévère migrateur
Rash maculopapulaire Surdité de perception Méningite chronique
Conjonctivite Amylose Dysmorphie faciale
Arthralgies distales Hypertrophies
épiphysaires
Cécité/surdité
Mortalité précoce
Autosomique Autosomique Autosomique dominant
dominant dominant sporadique ou familial
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%