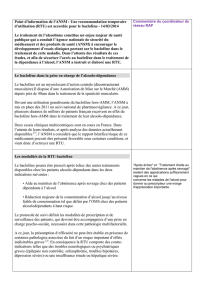
Fichier RTU 01092015

Les RTU sont élaborées par l’ANSM lorsque deux conditions sont réunies :
- l’existence d’un besoin thérapeutique dans l'indication concernée
- et un rapport bénéfice/risque du médicament présumé favorable
Les RTU peuvent s’appliquer à tous les médicaments ayant une AMM en France.
- elles ont une durée maximale de 3 ans renouvelable
- elles peuvent porter sur une indication ou des conditions d’utilisation différentes de celles de l’AMM
- une RTU peut concerner une seule spécialité pharmaceutique ou plusieurs appartenant à un groupe générique ou ayant un mécanisme d’action similaire.
CIRCADIN 2mg, comprimé à libération
prolongée Mélatonine RTU - Octroyée le 08/07/2015
Début le 01/10/2015
Traitement des troubles du rythme veille-sommeil liés à un syndrome de Rett, un syndrome de Smith-Magenis, un
syndrome d’Angelman, une sclérose tubéreuse ou à des troubles du spectre autistique chez l’enfant de plus de 6
ans
Liste des Spécialités faisant actuellement l'objet d'une RTU
Date d'octroi de RTUDCI Indications concernées par la RTU Documents de suivi
Bevacizumab RTU - Etablie le 24/06/2015 Début
le 01/09/2015
Formulaires de Visite d'initiation, Suivi et
arrêt du traitement. Formulaire patient
de déclaration d'effets indésirables
Portail de suivi des patients mis en ligne
au 05/10/2015. Fiche de suivi patient.
Note d'informations destinées aux
patients. Formulaires patient et
professionnel de santé de déclaration
Spécialité
AVASTIN 25mg/mL, solution à diluer pour
perfusion
Traitement de la dégénérescence maculaire liée à l'âge
Fiche de signalement des infections
nosocomiales
Formulaire patient de déclaration
d'évènements indésirables
Spécialités orales à base de Vérapamil
Isoptine 40 mg cp enrobé, Isoptine
120mg gélule, Isoptine LP 240mg cp
pélliculé sécable à libération prolongée,
Vérapamil RTU - Octroyée le 03/08/2015
Début le 05/10/2015 Traitement prophylactique de l'algie vasculaire de la face
Aide au maintien de l'abstinence après sevrage chez les patients dépendants à l'alcool et en échec des autres
Réduction majeure de la consommation d'alcool jusqu'au niveau faible de la consommation telle que défini par
Traitement des aphtoses sévères, y compris chez les patients HIV positifs et dans la maladie de Behçet, en cas
d’échec aux traitements de 1
ère
intention (traitements locaux et colchicine),
Traitement des formes cutanées du lupus érythémateux, y compris la maladie de Jessner-Kanof, en 2ème ligne
après échec des antipaludéens de synthèse (hydroxychloroquine et chloroquine),
Traitement des formes aiguës sévères de l’érythème noueux lépreux (réaction lépreuse de type II).
Traitement de la maladie de Crohn active, sévère chez les enfants de plus de 6 ans qui n’ont pas répondu à un
traitement approprié et bien conduit par corticoïde, immunosuppresseur ou anti-TNF ou chez lesquels ces
traitements sont contre-indiqués ou mal tolérés.
VELCADE 1 mg, poudre pour solution
VELCADE 3,5 mg, poudre pour solution
source: www.ansm.fr màj 01/09/15
Fiche initiale de recueil
Attestation mensuelle de traitement
RTU - Octroyée le 04/07/2014
Début le 27/10/2014
Formulaire patient de déclaration
d'évènements indésirables
Formulaire patient de déclaration
d'évènements indésirables
Formulaire patient de déclaration
d'évènements indésirables
Formulaire patient de déclaration
Formulaire patient de déclaration
d'évènements indésirables
Fiche de signalement de grossesse
Traitement de l’Amylose AL non IgM et de la maladie de Randall
REMICADE 100 mg, poudre pour solution
à diluer pour perfusion Infliximab
Bortézomib
LIORESAL 10 mg, comprimé sécable -
BACLOFENE Zentiva 10 mg, comprimé Baclofène RTU - Début le 17/03/2014
ROACTEMRA, 20 mg/ml solution à diluer
pour perfusion Tocilizumab RTU - Début le 07/04/2014
RTU octroyée le 02/03/2015 Début
le 02/04/2015
professionnel de santé de déclaration
d'effets indésirables
THALIDOMIDE CELGENE 50 mg, gélule Thalidomide
Traitement de la maladie de Castleman inflammatoire (à CRP élevée) non associée au virus HHV8
Traitement de la maladie de Takayasu réfractaire aux traitements conventionnels
Carte patient de collecte de données
RTU - Octroyée le 05/05/2015
Début prévu le 08/06/2015
pélliculé sécable à libération prolongée,
et génériques
1
/
1
100%