Hyper parathyroïdie primaire - Chirurgie

FCC 10 - Comment choisir la voie d’abord pour traiter l’hyperparathyroïdie primaire ?
SOMMAIRE
Président :
M. MATHONNET (Limoges)
Modérateurs :
F. MENEGAUX (Paris)
A. RAULT (Suresnes)
1. Y a-t-il un examen de localisation idéal pour choisir la voie d’abord d’une
HPT1 ?
M. GALIFET (Nancy)
2. Abord cervical bilatéral : bénéfices et risques
C. TRESALLET (Paris)
3. Abord cervical électif : la pratique, les risques
F. SEBAG (Marseille)
4. Reste-t-il une place pour la cervicoscopie ?
J.-C. LIFANTE (Lyon)
5. Intérêt de la PTH per-opératoire
L. DE CALAN (Tours)
6. Que faire en cas d’abord cervical électif négatif ?
E. MIRALLIE (Nantes)
7. Le bloc cervical : la pratique, les risques
B. CARNAILLE (Lille)
8. Les adénomes médiastinaux
F. TRIPONEZ (Genève, Suisse)

FCC 10 - Comment choisir la voie d’abord pour traiter l’hyperparathyroïdie primaire ?
EXISTE-T-IL UN EXAMEN DE LOCALISATION IDEAL POUR CHOISIR LA VOIE
D’ABORD DE L’HYPERPARATHYROÏDIE PRIMAIRE ?
M. Galifet, L. Brunaud, Nancy.
En 1986, John L. Doppman, radiologue américain, a dit : « The only useful localization
before a first surgical procedure for primary hyperparathyroidism is the localization of an
experienced surgeon ». Depuis, l’imagerie parathyroïdienne a considérablement évolué.
Qu’en est-il aujourd’hui, à l’ère de la chirurgie mini-invasive ? Deux examens tiennent le haut
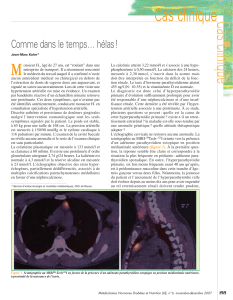
du pavé : l’échographie cervicale et la scintigraphie au MIBI (methoxy-isobutyl-isonitrile). En
préopératoire, la situation idéale est la concordance entre informations morphologiques et
fonctionnelles.
Voyons tout d’abord les points communs aux examens d’imagerie en matière
d’hyperparathyroïdie primaire. Dans une large étude prospective menée par Berber, sur
près de 1000 patients en hyperparathyroïdie primaire, les facteurs prédictifs de détection de
l’échographie et de la scintigraphie étaient l’indice de masse corporelle, la taille et le volume
de la glande pathologique 1. En matière de maladie multiglandulaire, les différents examens
sont globalement moins performants 2,3. Enfin, que ce soit en échographie, en scintigraphie
ou en IRM, l’interprétation est plus difficile en présence d’un goitre multinodulaire et aboutit à
des faux-positifs 4,5 .
L’échographie est un examen facile à réaliser et peu coûteux. En 2012, l’équipe de Lubitz à
Boston a comparé huit stratégies différentes pour la localisation parathyroïdienne, dont
l’échographie, la scintigraphie et la chirurgie 6. L’échographie était la moins chère de toutes.
Cet examen est particulièrement performant pour les lésions uniques en position cervicale,
ce qui est le cas de 85% des patients qui présentent une hyperparathyroïdie primaire. Sa
sensibilité oscille entre 73 et 93% 2,7. Sa valeur prédictive positive peut être très bonne entre
des mains entraînées, de l’ordre de 89 à 93% voire 100% dans une série de 46 patients
consécutifs où l’échographie était comparée à une scintigraphie MIBI ou thallium 2,7,8.
L’échographie est particulièrement sensible pour les lésions de poids faible, inférieur à 500
mg 4. Dans l’étude prospective de Berber, l’échographie était significativement plus
performante que la scintigraphie. La sensibilité de l’examen était significativement plus
élevée dans le sous-groupe des adénomes par rapport au sous-groupe des hyperplasies 1.
Toutefois, l’échographie reste un bon examen en cas d’hyperplasie, supérieur à la
scintigraphie 7,9. Un des écueils bien connus de l’échographie en général est son caractère
opérateur-dépendant. En matière de localisation dans l’hyperparathyroïdie primaire, il a été
montré que le fait de la faire pratiquer par un radiologue dédié voire un chirurgien
endocrinien était significativement plus efficace. Chez les 144 patients de la série
d’hyperparathyroïdie primaire opérées par cervicoscopie de Tublin, l’échographie était faite

FCC 10 - Comment choisir la voie d’abord pour traiter l’hyperparathyroïdie primaire ?
par un radiologue dédié et avait une meilleure précision que la scintigraphie (76 vs 51%) 9.
Dans l’étude rétrospective de Chandramohan portant sur 257 patients, l’échographie initiale
faite par un opérateur lambda était négative dans 23 % des cas et l’échographie de
rattrapage faite par un opérateur considéré comme expérimenté rattrapait 65% des lésions.
L’expérience en années des opérateurs de la deuxième échographie était significativement
plus élevée (p<.0001) 10. D’autre part, l’échographie permet une exploration cervicale
complète avec notamment l’exploration thyroïdienne à la recherche de nodules suspects,
éventuellement redevables d’une chirurgie 7. L’exploration ganglionnaire cervicale
concomitante est également possible.
La scintigraphie au MIBI est passée du domaine cardiologique à celui des parathyroïdes à la
fin des années 80; elle a vite supplanté la scintigraphie au thallium, plus irradiante. Le MIBI
n’est pas spécifique des parathyroïdes et son accumulation dans les thyréocytes nécessite
d’utiliser une méthode permettant de ne révéler que la fixation parathyroïdienne. La double
phase n’utilise qu’un seul isotope et repose sur la rétention différentielle dans le temps du
traceur entre thyroïde et parathyroïde. Elle nécessite de prendre des images précoces et
tardives. La méthode de soustraction permet l’acquisition simultanée des images ; les
images thyroïdiennes sont ensuite soustraites aux images parathyroïdiennes par ordinateur.
Enfin, des acquisitions obliques permettent d’obtenir des informations dans le plan sagittal.
Comme l’échographie, la scintigraphie est performante pour la localisation des lésions
uniques. Une équipe madrilène a sélectionné 136 patients consécutifs qui avaient tous sur
la scintigraphie avec méthode soustractive une fixation unique et a réalisé chez eux une
exploration chirurgicale unilatérale. La valeur prédictive positive de la scintigraphie était de
97,8% et augmentait à 98,4% pour les patients qui ne présentaient pas de nodules
thyroïdiens, source de faux-positifs 11. Dans l’article de Bhansali, la valeur prédictive positive
de la scintigraphie atteint 98% pour les lésions adénomateuses uniques 2. Certains auteurs
comme Leslie pensent que la méthode de soustraction est plus performante que la méthode
double-phase. Parmi 88 patients ayant bénéficié des deux types de scintigraphie, la méthode
de soustraction était significativement plus performante pour localiser correctement les
lésions uniques (72 versus 85%, p < 0.05) 3. Quoi qu’il en soit, les performances de cet
examen sont encore améliorées par l’utilisation de techniques comme le « pinhole » ou le
SPECT (single photon emission computerized tomography) qui consiste à fusionner aux
images fonctionnelles fournies par la scintigraphie des images morphologiques
tomodensitométriques. Cela permet d’obtenir des informations dans les trois plans de
l’espace et de les associer directement aux images fonctionnelles et explique la grande
sensibilité de la scintigraphie en ce qui concerne les adénomes ectopiques en position
médiastinale. Dans son étude prospective sur 52 patients qui ont tous bénéficié en
préopératoire d’une scintigraphie double-phase puis d’un SPECT et d’une scintigraphie de

FCC 10 - Comment choisir la voie d’abord pour traiter l’hyperparathyroïdie primaire ?
soustraction, Lorberboym montre que 79% des adénomes sont localisés par les images
planaires et que le SPECT augmente la sensibilité de détection à 96%, notamment en étant
plus performant chez les patients présentant une ectopie ou un goitre multinodulaire 12.
Enfin, certaines publications suggèrent que la scintigraphie serait d’autant plus rentable
lorsqu’elle est interprétée par un chirurgien endocrinien 13,14.
Beaucoup d’auteurs s’accordent pour dire que les deux imageries à réaliser en première
intention devant une hyperparathyroïdie primaire sont l’échographie et la scintigraphie MIBI.
Lorsque ces deux examens sont négatifs, d’autres examens non invasifs sont proposés, au
premier rang desquels on trouve le scanner avec injection de produit de contraste et l’IRM.
L’intérêt du scanner repose sur le fait que les adénomes parathyroïdiens sont
hypervascularisés. En 2006, Rogers a évalué un nouveau protocole de scanner incluant
l’analyse de la cinétique du produit de contraste dans le temps : le scanner en quatre
dimensions 15. Lubitz a évalué le scanner 4D chez 60 patients dont le bilan par échographie
et scintigraphie MIBI n’était pas concluant. Le taux de localisation exacte était de 60% ; le
côté de la glande pathologique était trouvé dans 73% des cas 16. Dans une étude
rétrospective de l’équipe new-yorkaise d’Inabnet, portant sur 63 patients dont le bilan
préopératoire était négatif, le scanner permettait la localisation du côté de la glande
pathologique avec une sensibilité de 85% et une spécificité de 94% et la localisation exacte
de la glande avec une sensibilité de 66% et une spécificité de 89%. Ceci avait permis une
chirurgie focalisée dans 2/3 des cas 17. Le temps opératoire était significativement plus court
lorsque la glande était localisée de manière exacte. Ce type de résultats fait dire à Nancy
Perrier que le scanner pourrait devenir un examen de première intention en matière
d’hyperparathyroïdie primaire grâce à sa facilité de réalisation, son coût et l’absence
d’utilisation de produit radioactif 18.
L’imagerie par résonance magnétique fait partie des examens non invasifs utilisés dans la
prise en charge de l’HPT primaire. Bien que moins facile à obtenir, elle a l’avantage par
rapport au scanner d’être non irradiante. Cakal et al ont évalué 39 patients en
hyperparathyroïdie primaire à l’aide d’une échographie, d’une scintigraphie au MIBI et d’une
IRM. Les sensibilités respectives de ces examens étaient de 89,7%, 71,8% et 66,7%. Les
valeurs prédictives positives étaient de 97,1%, 96% et 100% 19. La sensibilité et sa valeur
prédictive positive de l’IRM sont tout à fait comparables à celles de la scintigraphie MIBI :
94,3% et 96,15% versus 88 et 93,6 dans une étude prospective portant sur 58 patients. La
valeur prédictive positive combinée des deux examens était de 98% 20.
Parmi les examens plus récents, on compte le Pet scan à la méthionine ou MET-PET. Une
méta-analyse de 9 études sur 258 patients évaluait la sensibilité de cet examen à 81% et le
suggérait comme alternative intéressante en cas de négativité des techniques
conventionnelles 21. Sa disponibilité actuelle est le frein principal à son utilisation.

FCC 10 - Comment choisir la voie d’abord pour traiter l’hyperparathyroïdie primaire ?
L’exploration virtuelle du cou en trois dimensions fait partie des dernières innovations
techniques en matière de localisation dans l’hyperparathyroïdie primaire. L’équipe de
Marescaux à Strasbourg a utilisé cette méthode chez 114 patients et l’a comparée à
l’échographie, la scintigraphie MIBI et le scanner. Sa sensibilité était significativement
supérieure aux trois autres examens 22.
A l’heure actuelle, les deux examens les plus réalisés restent l’échographie et la
scintigraphie MIBI. Les atouts de l’échographie reposent sur sa facilité d’obtention, sa
réalisation possible par le chirurgien lui-même, son faible coût intrinsèque et son caractère
non irradiant. Elle est plus sensible pour les adénomes de faible poids et pour la maladie
multiglandulaire. Contrairement à la scintigraphie, elle ne permet pas la localisation des
adénomes ectopiques médiastinaux ou cervicaux profonds. Toutefois, ces cas ne
répresentent que 10% des hyperparathyroïdies primaires. Chacun de ces deux examens a
donc ses propres avantages et inconvénients. De manière raisonnable et pour obtenir une
localisation exacte dans le maximum de cas, il semble judicieux d’associer ces deux
examens, l’idéal étant qu’ils soient interprétés par la même personne. La sensibilité conjointe
de ces deux examens est en effet nettement améliorée : 90% versus 77% pour la
scintigraphie et l’échographie seules chez Solorzano, qui conclut que l’échographie doit être
réalisée en première intention et complétée aux besoins par la scintigraphie MIBI 23. Kwon
suggère également que les deux imageries sont complémentaires, notamment dans les cas
d’adénomes multiples 7.
Au final, le meilleur examen est celui que l’on peut obtenir le plus facilement dans sa
pratique quotidienne et qui est réalisé par un opérateur entraîné en qui l’on a toute
confiance.
Références :
1. Berber E, Parikh RT, Ballem N, et al. Factors contributing to negative parathyroid
localization : an analysis of 1000 patients. Surgery 2008 ; 144 : 74-9.
2. Bhansali A, Masoodi SR, Bhadada S, et al. Ultrasonography in detection of single and
multiple abnormal parathyroid glands in primary hyperparathyroidism : comparison with
radionuclide scintigraphy and surgery. Clin Endoc 2006 ; 65 : 340-45.
3. Leslie WD, Dupont JO, Bybel B, et al. Parathyroid 99mTc-sestamibi scintigraphy: dual-
tracer subtraction is superior to double-phase washout. Eur J Nucl Med 2002 ; 29 : 1566-70.
4. Barczynski M, Golkowski F, Konturek A, et al. Technetium-99m-sestamibi subtraction
scintigraphy vs. ultrasonography combiend with a rapid parathyoid hormone assay in
parathyroid aspirates in preoperative localization of parathyroid adenomas and in directing
surgical approach. Clin Endoc 2006 ; 65 : 106-113.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
1
/
26
100%