generalites sur la chimie organique

1
GENERALITES SUR LA CHIMIE ORGANIQUE
1. MOLES ET GRANDEURS MOLAIRES
Grandeurs
chimiques
Symbole
unité
Formules
Constante
d’Avogadro
Nombres
d’entités
élémentaires
Sans unité
Quantité de
matières ou
nombre de moles
Masse molaire
Masse
Volume molaire
(gaz)
Volume (gaz)
Densité (gaz)
Sans unité
2. Analyse d’un compose organique
2.1. Densité
La densité d’un liquide d’un solide est ou d’un solide est exprimée par rapport à l’eau :
est la masse volumique du corps considéré et celle de l’eau .
La densité d’un gaz est exprimée par rapport à l’air :
M est la masse molaire du gaz
considéré en et 29 est celle de l’air.
La densité d’un corps n’a pas d’unité.
hschool.ci | Apprendre - Tester - Partager

2
2.2. Analyse élémentaire quantitative
a. But
Elle consiste à déterminer la composition centésimale d’un corps ou le pourcentage massique de
chaque élément contenu dans le composé et à en déduire sa formule brute.
b. Définition
Le pourcentage massique d’un élément A dans un composé est donné par les expressions :
Remarque : dans un composé organique la somme des pourcentages massiques de tous les éléments
est égale à 100.
c. Exemple 1
Considérons un composé organique de formule brute de formule brute et de masse molaire
M.
Pourcentage massique des éléments
Formule brute :
;
Masse molaire du composé :
d. Exemple 2
La combustion d’un composé organique de masse donne de dioxyde de carbone
et d’eau.
Masse et pourcentage massique de carbone :
Il ya 12 g de C dans 44 g de donc dans il y aura
Et
Masse et pourcentage massique d’hydrogène :
Il ya 2g de H dans 18 g de donc dans il y aura
Pourcentage massique d’oxygène :
3. Méthodes Pratiques
3.1. Comment déterminer la masse molaire M d’un composé ?
Par la relation la liant à sa masse m et à son nombre de moles
Par sa densité par rapport à l’air
hschool.ci | Apprendre - Tester - Partager

3
Par ses pourcentages massique :
3.2. Comment déterminer la formule brute d’un composé
Par sa masse molaire : 1
Par le bilan molaire de l’équation de sa combustion :
Par ses pourcentages massiques :
3.3. Comment déterminer le rendement r au cours d’une réaction chimique ?
Exemple : le rendement de la transformation d’un corps A en un corps B est
où n est la quantité du corps considéré (en mol) et r le rendement (sans unité).
4. ALCANES
4.1. Définition
Ceux sont les hydrocarbures saturés( les liaisons sont simples) de formule générale
4.2. Nomenclature
a. Alcane à la chaîne linéaire
Le nom d’un alcane à la chaîne linéaire se forme en associant un préfixe qui indique le nombre
d’atomes de carbone de la chaîne à la terminaison « ane », à la l’exception des quatre premiers qui
portent des noms usuels.
Remarque : pour signifier que la molécule est linéaire (normale), on fait précéder son nom par « n-«
à partir de quatre atomes de carbone (où on peut avoir une chaîne ramiffiée).
Exemples :
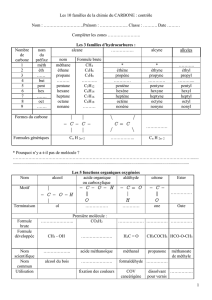
Nombre
d’atomes de
carbonne
1
2
3
4
5
6
7
8
9
10
Formule brute
Nom
Méthane
Ethane
Propane
n-butane
n-pentane
n-hexane
n-
heptane
n-
octane
n-nonane
n-décane
hschool.ci | Apprendre - Tester - Partager

4
b. Groupe alkyle
C’est un groupe monovalent d’atomes obtenu en retirant un atome d’hydrogène à un alcane. Son
nom est obtenu en remplaçant, dans le nom dans le nom de l’alcane correspondant, le suffixe
« -ane » par le suffixe « -yle ». sa formule générale est .
Exemples :
Nbre de C
1
2
3
4
Formule
Nom
méthyle
éthyle
propyle
Méthyléthyle
ou
isopropyle
Butyle
1-méthylpropyle
2-méthylpropyle
1,1-diméthyléthyle
c. Alcane à chaîne ramifiée
Son nom est constitué des groupes alkyles (privés de voyelle e) précédés de leur indices de position
et suivis du nom de l’alcane linéaire de même chaîne principale. Le principe est le suivant :
Chercher la chaîne carbonée la plus longue, appelé chaîne principale : le nombre
d’atome de cette chaîne détermine le nom de l’alcane ;
Déterminer la position des groupes alkyles en numérotant les atomes de
carbones de la chaîne principale. Cette numérotation se fait dans n’importe quel
sens de telle sorte que le sens choisit donne l’ensemble des indices les plus bas
possible ;
Si un groupe alkyle est plusieurs fois présent, son nom est précédé des préfixes
di- (2), tri- (3), tétra- (4), etc ;
Si l’alcane est constitué de différents groupes alkyles, ils sont énoncés dans
l’ordre alphabétique
Exemples :
2-méthylpropane 2,3-diméthylpentane 4-éthyl-3-méthylheptane
hschool.ci | Apprendre - Tester - Partager

5
d. Isomérie
Deux composés sont dits isomères s’ils ont la même formule brute mais des formules développées
différentes.
Exemple :
2-méthylbutane n- pentane
5. ALCENES
5.1. Définition
Ceux sont des hydrocarbures insaturés (toutes les liaisons ne sont pas simples) de formule générale
avec il comportent une seule double liaison
5.2. Nomenclature
Le nom d’un alcène comporte toujours la terminaison « -ène » précédée de l’indice de position de la
double liaison dans la chaîne principale.
Le principe est le suivant :
Déterminer la chaîne carbonée la plus longue, appelée chaîne principale, contenant la double
liaison ;
Numéroter les atomes de carbone de la chaîne, principale de telle sorte que l’indice de la
double liaison soit le plus bas possible ; cet indice est le numéro du premier carbone
rencontré participant à la double liaison. Il se place entre le préfixe indiquant le nombre de
carbone de la chaîne principale et le suffixe « ène » ;
Pour les groupes alkyles, on procède comme chez les alcanes.
Exemples :
2-méthylpropène 2,3-diméthylpent-2-ène hept-3-ène
5.3. Isomérie
a. Isomérie de chaîne
Isomérie de chaîne
Ces isomères ne diffèrent que par leur chaîne carbonnée.
hschool.ci | Apprendre - Tester - Partager
 6
6
 7
7
 8
8
 9
9
1
/
9
100%