R10

^11
keM^-e_
I]
CHIMIE
:
éf^tW
(/T)
Un
médicament pouvant soulager des douleurs contient un principe actif : la benzocaïne ou 4-aminobenzoate
d'éthyle, que l'on notera E, de
masse
molaire moléculaire : 165 g.mol"1, et
dont
la formule
topologique
est :
o
H2N-
On veut préparer E à partir d'un acide, l'acide 4-aminobenzoïque, noté HA, de
masse
molaire moléculaire : 137 g.mol"1
et d'un composé chimique,
liquide
à température ambiante, noté B, de
masse
molaire moléculaire : 46,0 g.mol'1.
11 Étapes
successives
du mode opératoire
a.
On
introduit
une
masse
mHA = 1,37 g de HA, solide constitué de cristaux blancs, et un volume : VB = 11,5 mL du
réactif B, de
masse
volumique 0,800 g.cm"3, dans un ballon de 100 mL.
On agite doucement et on place alors le ballon dans un bain de glace.
b. On ajoute peu à peu 1,5 mL d'acide sulfurique,
H2S04,
à 8,0 mol L'1.
c.
On chauffe à reflux pendant 1 heure.
d.
On
verse
alors le mélange très acide obtenu dans un bêcher où l'on ajoute une solution de carbonate de sodium,
(2
Na+aq
+
C032"aq)
à 20% en mélangeant le
tout
jusqu'à
obtenir
une solution ayant un pH égal à 9,0. On observe
un dégagement de gaz et la
formation
d'un précipité de sulfate de sodium solide.
e.
On élimine ce solide par
filtration.
f. On rince le bêcher
avec
15 mL d'éther et le
filtrat
est placé dans une ampoule à décanter.
g.
On récupère la phase organique et on élimine la phase aqueuse.
h. On évapore le solvant de la phase organique
sous
la
hotte.
Une huile apparaît qui se solidifie dans un bain de glace.
i. On pèse le solide S obtenu. On trouve : ms = 0,825 g.
x,
I
1
Données PK, des couples ac de /
base
à 25°C
AH / A"aq : pK, = 4,9 ; H20 / HOaq : pK, = 14 ;
H30+aq
/ H20 : pK, = 0,0.
HA 4
A/a
E
B
éther
Solubilité dans
100 mL d'eau Très faible Très soluble Très faible infinie 7,5 g
Solubilité dans
100 mLde B 11,3g Très faible
20,0
g infinie
Solubilité dans
100 mL d'éther 8,2 g Très faible
14,3
g infinie
—-—

Vf
OJ^^J^Q/fty
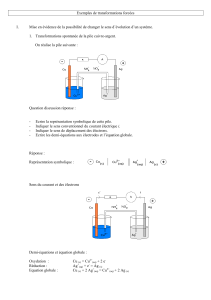
On
considère
une
pile
formée
par les
deux
demi-piles
suivantes
:
^-=5ne
électrode d'étain
dans
un bêcher contenant une solution
Si
de chlorure
d'étain
;
,
-
une
électrode
de
fer
dans
un
bêcher
contenant
une
solution
S2
de
chlorure
de
fer (II)
;
-
un
pont
salin
contenant
une
solution
de
nitrate
d'ammonium
Le
volume
de
solution
dans
chaque
demi-pile
vaut
V
=
100 mL.
Cette
pile
alimente
une
résistance
R.
Un
ampèremètre
permet
de
mesurer
l'intensité
parcourant
le
circuit.
La
borne
'COM' de
l'ampèremètre
est
reliée
à
l'électrode
d'étain,
l'autre borne est reliée
à
l'électrode de
fer.
On
lit
alors
une
valeur
d'intensité
de
-87 mA.
La
pile
fonctionne
pendant
une
heure.
A.
L'ampèremètre
indique
une
valeur
négative
car
il
est
branché
en
dérivation
aux
bornes
de
la
pile.
B.
La
plaque
d'étain
constitue
le
pôle négatif
de
cette
pile
C. Les
ions
NH4+
(aq)
et
N03"(aq)
contenus
dans
le
pont
salin
assurent
le
passage
du
courant
entre
les
deux
demi-piles.
D.
La
concentration
en
ions
Fe2+(aq)
varie
de
+
16
mmol.L"1.
E.
Aucune
des
propositions
précédentes
n'est
exacte.
Oi^-ûk
(CL/Jne
Pile
formée
des
couples
Ag+(aq/Ag(S)
et
Zn^aq/Zn^
débite
dans
un
circuit.
Quelle
est
l'intensité
I
du
courant
sachant
que la
variation
de
masse
de
l'électrode
d'argent
est
de
Am(Ag)
=
1,10
g
en
10
heures
:
A. 9,5 mA B. 27,3 mA C. 13,9 mA
D.
36,5 mA
E.
73,0 mA
-P
tot^^^<C0Que'les
sont
les
affirmations
exactes
?
Une
réaction
d'électrolyse
a
lieu
grâce
à
l'apport
d'énergie
électrique
fournie
par
le
générateur
B.
Lors
d'une
électrolyse,
il
y
a
réduction
à
l'anode et
oxydation
à la
cathode,
contrairement
à
ce
qu'il
se
passe
dans
une
pile
\J
l
C.
Lors
d'une
électrolyse,
il y
a
réduction
à l'électrode reliée
au
pôle
- du
/
C
générateur
et
oxydation
à
l'électrode
reliée
au
pôle
+
du
générateur
I
>
D. Un
électrolyseur
est
caractérisé
par une
force
électromotrice
et une
résistance
interne
E.
Dans
le
pont
salin,
les
cations
se
déplacent
vers
la
cathode
et les
anions
vers
l'anode
lors
de
l'électrolyse
MÏS^uelles
sont
les
affirmations
exactes
?
KTT-'électrode
d'entrée
du
courant
dans
un
électrolyseur
est
appelée
cathode
B.
Lorsqu'on
souhaite
déposer
un
métal
sur un
objet,
le
métal
à
déposer
doit
être
placé
à
l'anode
C.
Lorsqu'on
souhaite
déposer
un
métal
sur
un
objet,
l'objet doit
être placé
à
\J
I
l'anode
/p
D.
Lors
de la
purification
d'un
métal
par un
procédé
à
anode
soluble,
le
métal
non
I
pur
doit
être placé
à
l'anode
E.
Lors
de la
purification
d'un
métal
par un
procédé
à
anode
soluble,
le
métal
pur
se
dépose
à
l'anode

A
Parmi
ces
affirmations
concernant
les
alcanes
lesquelles
s'ont
correctes
?
•
a.
La
formule
générale
des
alcanes
linéaires
est
CH2/1.
•
b.
Un
alcane
est
un
hydrocarbure
saturé.
•
c.
Un
alcane
est
une
molécule
ne
possédant
que
des
liaisons
simples
carbone-carbone
et
carbone-
hydrogène.
•
d.
Les
alcanes
sont
très
réactifs.
•
e.
Les
alcanes
peuvent
subir
des
réactions
d'addi-
tion.
On
fait
le
vide
dans
un
flacon
que
l'on
remplit
avec
un
alcane
gazeux
A.
On
détermine
la
masse
de
gaz
introduite
pour
remplir
le
flacon
m
A
—
6,473
g.
On
fait
de
nouveau
le
vide
dans
le
flacon
et
on
le
remplit,
dans
les
mêmes
conditions
de
températures
et
de
pression
avec
de
l'éthane
gazeux
E,
on
trouve
alors
rriE
=
3,348
g.
Calculer
la
masse
molaire
(en
g.mol"')
de
l'alcane
gazeux.
•
a.
44
•
b.
54
•
c.
58
•
d.
72
•
e.
86
•
f.
Aucune
réponse
exacte.
3.
On
réalise
le
combustion
complète
d'un
volume
de
150
mL
d'un
alcane
gazeux.
Cette
combustion
nécessite
un
volume
minimum
de
750
mL
de
dioxygène
gazeux.
Il
se
forme
du
dioxyde
de
carbone
et
de
l'eau.
Les
volumes
gazeux
sont
mesurés
dans
les
mêmes
conditions
de
température
et
de
pression.
Calculer
la
masse
molaire
(en
g.mol
')
de
l'alcane
gazeux.
•
a.
16
•
b.
30
•
c.
44
•
d.
58
•
e.
72
•
f.
Aucune
réponse
exacte.
4.
Parmi
ces
affirmations
concernant
les
alcènes
lesquelles
sont
correctes
?
•
a.
Les
alcènes possèdent
une
liaison
double
entre
deux
atomes
de
carbone.
•
b.
Un
alcène
est
un
hydrocarbure
saturé.
•
c.
Le
nom
de
l'alcène
porte
la
terminaison
« ène
».
•
d.
La
formule
générale
des
alcènes
est
C„H2„-2.
•
e.
Les
alcènes
peuvent
subir
des
réactions
d'addi-
tion.
5.
Parmi
ces
affirmations
concernant
les
réactions
d'addi-
tions
sur
les
alcènes
lesquelles
sont
correctes
?
•
a.
Lors
d'une
addition
sur
un
alcène,
la
double
liai-
son
carbone-carbone
laisse
place
à
une
liaison
simple.
•
b.
L'hydrogénation
d'un
alcène
consiste
à
ajouter
un
atome
d'hydrogène
sur
chacun
des
atomes
de
carbone
de
la
double
liaison.
•
c.
L'hydrogénation
d'un
alcène
conduit
à
un
alcool.
•
d.
L'addition
de
chlorure
d'hydrogène
HC1
sur
un
alcène
conduit
à
un
dérivé
monohalogéné.
•
e.
L'hydratation
(ou
addition
d'eau)
du
propène
peut
a
priori
conduire
à
deux
alcools
différents.
1
/
3
100%