Partie 3 : Biochimie ( 20 points)

1
CORRECTION BAC BLANC BIOCHIMIE
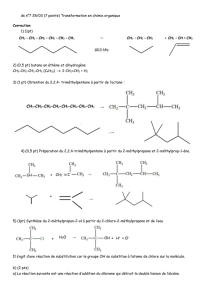
1. Etude structurale de la tributyrine
1.1- formule générale d’un triglycéride :
CH2 – O – CO – R1
|
CH – O – CO – R2
|
CH2 – O – CO – R3
Un triglycéride homogène est un ester de glycérol et de 3 acides gras identiques
1.2.1- formule brute des acides gras saturés : CnH2nO2
1.2.2- la formule développée de l’acide butyrique et numérotation des C :
N° des carbones : 4 3 2 1
H3C – CH2 – CH2 – COOH
Apolaire Polaire
1.2.3- molécule amphiphile
1.3- réaction de saponification de la tributyrine par l’hydroxyde de potassium :
CH2 – O – CO – (CH2)2 – CH3
|
CH – O – CO – (CH2)2 – CH3 + 3 x KOH
|
CH2 – O – CO – (CH2)2 – CH3
Tributyrine hydroxyde de potassium
CH2 – OH
|
CH2 – OH + 3 x H3C – (CH2)2 – COO - ; K +
|
CH2 – OH
Glycérol savon ou ion carboxylate
2. Enzymologie
2.1- La vitesse initiale vi d’une réaction correspond à la vitesse au début de la réaction
pendant la phase stationnaire initiale.
On la détermine graphiquement en calculant la pente de la droite de la période stationnaire
initiale sur la courbe [P] = f(t).
2.2.1- L’équation de Michaelis-Menten est : vi = (Vmax . [S]) / (Km + [S])
2.2.2- Cette courbe a une allure hyperbolique.
On remarque que plus la [S] augmente plus la vi augmente jusqu’à une certaine [S] où vi
n’augmente plus (on obtient un plateau) ce qui montre que la catalyse enzymatique est un
phénomène saturable.
2.2.3- significations des paramètres de la cinétique :
Vmax : vitesse initiale maximale : c’est la vitesse de réaction lorsque toutes les enzymes
sont saturés par un S c’est-à-dire lorsqu’elles sont toutes sous forme de complexe ES.
Placement de Vmax et valeur : Vmax = 0,24 mol/min
Placement de Km et valeur : Km = 0,04 mol/L

2
2.2.4- On pourrait tracer la courbe de Lineweaver-Burk (ou courbe des doubles-inverses) :
1/vi = f(1/[S]) qui correspond à une droite et qui permet de déterminer avec une plus grande
précision les valeurs des paramètres de la cinétiques.
2.3.1- acides aminés
2.3.2- site actif (ou site catalytique)
2.3.3- hydrolase
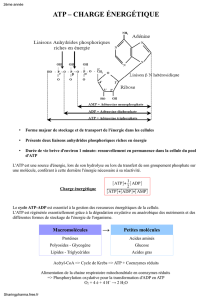
3. Métabolisme de l’acide butyrique
3.1.1- cytoplasme (ou membrane externe de la mitochondrie côté cytoplasmique)
3.2.2- réaction de l’activation de l’acide butyrique :
Acide butyrique + ATP + CoA-SH butyryl-coA + AMP + PPi
Nom de l’enzyme : acyl-coA synthétase
3.2.1-
E1 : acyl-coA dehydrogenase
E2 : dehydroacyl-coA hydratase
E3 : β-hydroxyacyl-coA deshydrogenase
E4 : β-cetothiolase
Dans l’ordre, les coenzymes et substrats :
- FAD et FADH2
- déhydroacyl-coA ou déhydrobutyryl-coA
- H2O
- β-hydroxyacyl-coA ou β-hydroxybutyryl-coA
- NAD+ et NADH,H+
- β-cetoacyl-coA ou β-cetobutyryl-coA
- acétyl-coA
- acétyl-coA
3.2.2- Bilan moléculaire de la dégradation de l’acide butyrique en acétyl-coA :
Activation : Acide butyrique + ATP + CoA-SH butyryl-coA + AMP + PPi
β-oxydation : butyryl-coA + FAD + H2O + NAD+ + coA-SH 2 acétyl-coA + FADH2 + NADH,H+
BILAN : Acide butyrique + ATP + 2 CoA-SH + FAD + H2O + NAD+ 2 acétyl-coA + FADH2 +
NADH,H+ + AMP + PPi
3.3- Bilan énergétique de la dégradation complète de l’acide butyrique :
2 acétyl-coA => 2 x 12 ATP = 24 ATP
1 FADH2 => 1 x 2 ATP = 2 ATP
1 NADH,H+ => 1 x 3 ATP = 3 ATP
TOTAL 29 ATP – 2 ATP (pour l’activation)
Soit 27 ATP formés
1
/
2
100%