Prolifération cellulaire dans le muscle tibial crânial

Introduction
Le muscle strié squelettique est un organe complexe
constitué par l’association de plusieurs tissus, dont le tissu
musculaire composé de fibres musculaires et de cellules
satellites, le tissu conjonctif, les vaisseaux sanguins et lym-
phatiques et les formations nerveuses.
L’aptitude du muscle squelettique adulte à régénérer suite à
un traumatisme physique ou chimique est bien connue [1, 6,
7, 10].
L’issue favorable de la régénération musculaire dépend de
la nature du traumatisme, mais surtout de facteurs tels que la
revascularisation, la phagocytose des éléments nécrotiques,
la prolifération des cellules satellites [14] et leur fusion soit
en myotubes multinucléés, soit avec les fragments de fibres
endommagées. Enfin la «re-innervation» des fibres régéné-
rées achève leur différenciation en fibres adultes [16].
Le traumatisme par écrasement musculaire est un modèle
expérimental d’étude de la régénération musculaire dans
lequel les différents compartiments tissulaires du muscle
(cellule musculaire, armature conjonctive, réseau vasculaire
et formations nerveuses) sont lésés dans des proportions
variables [11, 15, 21].
Aussi, la prolifération cellulaire dans un tel modèle expéri-
mental intéresse d’une part les cellules de réserve du muscle
(les cellules satellites) et d’autre part d’autres cellules comme
les macrophages, les cellules endothéliales, les fibroblastes,
les cellules de Schwann.
Dans cette étude nous avons utilisé le PC10, un anticorps
dirigé contre l’antigène de prolifération nucléaire (PCNA /
Cyclin) pour marquer les cellules en prolifération dans le
muscle tibial crânial (M. tibialis cranialis) écrasé chez le rat.
Le but de ce travail est de décrire l’évolution temporelle et la
répartition tissulaire de la prolifération cellulaire dans ce
modèle expérimental.
ARTICLE ORIGINAL
Prolifération cellulaire dans le muscle tibial
crânial (M. tibialis cranialis) écrasé de rat.
I : évolution temporelle et répartition intra
et extra-fasciculaires des cellules activées
° S. BAKOU*, °° Y. KANE, ° T. BENGONE-N’DONG et °° C. BIAOU
° Département des sciences biologiques et productions animales, École Inter - États des Sciences et Médecine Vétérinaires, B.P. 5077, Dakar - Fann, Sénégal
°° Département de santé publique et environnement, École Inter - États des Sciences et Médecine Vétérinaires, B.P. 5077, Dakar - Fann, Sénégal
* Correspondance et tirés-à- part
RÉSUMÉ
Dans le but de décrire l’évolution temporelle et la répartition tissulaire de
la prolifération cellulaire après écrasement du muscle tibial crânial (M.
tibialis cranialis) chez le rat, le PC10, un anticorps dirigé contre l’antigène
de prolifération nucléaire (PCNA / Cyclin) a été utilisé. A partir de J1 (un
jour après le traumatisme) la prolifération cellulaire est observée aussi bien
dans les faisceaux des fibres musculaires (prolifération cellulaire intrafasci-
culaire) qu’en dehors des faisceaux des fibres musculaires (prolifération
cellulaire extrafasciculaire). La prolifération cellulaire est d’emblée maxi-
male à J1 et J2 aussi bien dans les faisceaux qu’en dehors des faisceaux
musculaires. Toutefois, la prolifération intrafasciculaire est plus importante
que la prolifération extrafasciculaire (53 % contre 33 % à J2). Ensuite, le
nombre de cellules activées dans les muscles écrasés diminue régulièrement
pour être identique à celui des muscles témoins à J14 (prolifération extra-
fasciculaire) et à J28 (prolifération intrafasciculaire).
MOTS-CLES : Muscle - Prolifération cellulaire -
Ecrasement musculaire - Rat.
SUMMARY
Cell proliferation in rat tibialis cranialis muscle crushed - I: Time course
and distribution of activated cells. By S. BAKOU*, Y. KANE, T.BEN-
GONE-N’DONG and C. BIAOU.
In the aim of describing the time course and distribution of the cell pro-
liferation in rat tibialis cranialis muscle crushed, PC10, an antibody direc-
ted against the proliferating cell nuclear antigen (PCNA/cyclin) has been
used. From day 1 after crushing, cell proliferation is observed in fasciculi or
muscle bundle (intrafascicular proliferation) as well as outside of fasciculi
(extrafascicular proliferation). Right away, the cell proliferation is maxi-
mum at day 1 and day 2 in fasciculi as well as outside of fasciculi.
Nevertheless, the intrafascicular proliferation is more important than the
extrafascicular proliferation (53 % against 33 % at day 2). Then, the num-
ber of activated cells in crushed muscles decreases regularly to be identical
to control muscles 14 days after crushing (extrafascicular proliferation) and
28 days after crushing (intrafascicular proliferation).
KEYS-WORDS : muscle - cell proliferation - crushing -
rat.
Revue Méd. Vét., 2003, 154, 6, 415-419

Matériel et Méthodes
A) MATERIEL ANIMAL
Vingt-huit rats mâles de souche Wistar pesant entre 90 et
120 g ont été utilisés dans cette étude. Les animaux ont été
entretenus dans des cages et ont reçu de l’aliment commer-
cial pour rongeurs et de l’eau à volonté.
B) METHODES EXPERIMENTALES
1. Induction du traumatisme musculaire
Le traumatisme musculaire est induit par écrasement entre
les bras d’une pince hémostatique du muscle tibial crânial
(M. tibialis cranialis) droit, le muscle gauche servant de
témoin interne. Après anesthésie générale gazeuse, les ani-
maux sont placés en décubitus dorsal, la zone opératoire est
désinfectée avec de l’hexamédine (Hexomédine N.D.). La
peau est incisée longitudinalement sur 2 cm environ sur le
bord crânial de la jambe. Le muscle tibial crânial (M. tibialis
cranialis) est mis à nu, puis écrasé deux fois de suite à l’aide
de la pince hémostatique placée transversalement au niveau
de son ventre. La plaie cutanée est suturée par un point
simple à l’aide d’un fil irrésorbable (Flexidène ND). Durant
la période post-traumatique, les animaux sont entretenus
librement en cages individuelles.
2. Réalisation des prélèvements musculaires
Quatre animaux choisis au hasard sont euthanasiés à 1, 2,
3, 7, 14, 21 et 28 jours post-traumatique par dislocation des
vertèbres cervicales après anesthésie générale gazeuse.
Sur chaque animal, les muscles tibial crânial (M. tibialis
cranialis) droit et gauche sont individualisés et désinsérés de
leurs supports osseux.
Des sections de 1 cm de long sur 0,5 cm de large sont réa-
lisées sur chaque muscle et les fragments ainsi obtenus sont
fixés dans du formol à 10 %. Les fragments fixés subissent le
processus d’inclusion en blocs de paraffine.
Sur ces blocs de paraffine il a été réalisé des coupes trans-
versales et longitudinales de 5 µm d’épaisseur à l’aide d’un
microtome de type rotatif (Microtome LEITZ 1512).
Collées sur des lames «Polysine», elles sont ensuite
séchées à l’étuve avant de subir les différents traitements
immunocytochimiques pour la mise en évidence du PCNA /
Cyclin (Antigène nucléaire de prolifération cellulaire).
3. Mise en évidence du PCNA / Cyclin
La technique immunoenzymatique indirecte streptavidine-
biotine-peroxydase sur les coupes histologiques a été utilisée
dans cette étude pour détecter le PCNA / Cyclin. Les coupes
subissent un pré - traitement au micro-ondes et sont «trypsi-
nées» à 37°C. Elles sont incubées dans du peroxyde d’hydro-
gène à 3 % dans l’eau distillée afin d’éliminer les éventuelles
peroxydases endogènes. Les fixations non spécifiques sont
supprimées avec l’apport de sérum de chèvre à 20 % dans du
P.B.S. à pH 7,6 sur les coupes tissulaires. Elles sont ensuite
incubées avec l’anticorps primaire monoclonal anti-souris
PCNA-PC10 (DAKO, M.879) dilué au 1/1000 dans du P.B.S.
à pH 7,6 contenant 2 % de B.S.A. (Sérum Albumine de
Bovin) et 10 % de sérum de rat pendant 1 heure à 37°C en
chambre humide.
L’incubation avec l’anticorps de liaison anti-souris (IgG
biotinylée, DAKO, E.433) diluée au 1/300 dans du P.B.S. à
pH 7,6 contenant 2 % de B.S.A. et 10 % de sérum de rat pen-
dant 30 minutes à température ambiante est suivie par l’ad-
jonction d’une solution de streptavidine marquée par la per-
oxydase (DAKO, P.397) diluée au 1/300 dans du P.B.S. à pH
7,6 contenant 2 % de BSA. Trente minutes après, l’activité
enzymatique de la peroxydase est révélée par adjonction du
substrat : le tétrahydrochlorure de diaminobenzidine [(DAB
liquide) (DAKO, K.3465)]. Une contre-coloration par l’hé-
matoxyline de Harris est réalisée sur les coupes pour visuali-
ser les noyaux non activés.
4. Analyse morphométrique
Le nombre de cellules activées suite à l’écrasement muscu-
laire a été compté à partir de la réaction immunocytochi-
mique révélant le PCNA par des méthodes semi-automa-
tiques utilisant un analyseur d’image (VIDS IV, Analytical
Measuring Systems, London Road Pampisford, Cambridge
CB2 4EF, UK.).
Le nombre de noyaux marqués est déterminé sur environ
2500 fibres musculaires (zone intrafasciculaire) ou sur la sur-
face équivalente (zone extrafasciculaire) et le résultat final
exprimé en nombre de cellules activées pour 100 fibres mus-
culaires.
5. Analyse statistique
L’analyse de variance (ANOVA) et des tests de Fischer-
PLSD ont été utilisés pour comparer le nombre de cellules
activées entre les muscles lésés et témoins et à l’intérieur des
7 groupes (1, 2, 3, 7, 14, 21 et 28 jours). L’intervalle de
confiance statistique de 95 % a été retenu.
Résultats
La prolifération des cellules satellites dans les muscles
tibial crânial (M. tibialis cranialis) écrasé et témoin de rat
s’est traduite, sur le plan morphologique, par une coloration
brune par le P.C.N.A / Cyclin des noyaux en phase G1 et S du
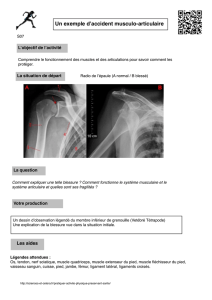
cycle cellulaire. Elle est observée dès J1 aussi bien dans les
faisceaux des fibres musculaires (Figure 1A) qu’en dehors
des faisceaux des fibres musculaires (Figure 1B).
A. PROLIFERATION CELLULAIRE INTRAFA S C I C U -
LAIRE
L’écrasement du muscle tibial crânial (M. tibialis crania -
l i s ) a entraîné une prolifération cellulaire au sein des fais-
ceaux de fibres musculaires dès J1. Cette prolifération est
d’emblée maximale à J1 et J2 avec 48 et 53 cellules activées
pour 100 fibres musculaires respectivement (Figure 2A).
Ensuite, le nombre de cellules activées diminue régulière-
ment mais vingt et un jours après le traumatisme, il subsiste
toujours plus de cellules activées dans les muscles lésés que
sur les muscles témoins.
Revue Méd. Vét., 2003, 154, 6, 415-419
416 BAKOU (S.) ET COLLABORATEURS

Enfin, vingt huit jours après le traumatisme, le nombre de
cellules activées dans les muscles écrasés est identique à
ceux des muscles témoins c’est-à-dire de 1 cellule pour 100
fibres musculaires.
B. PROLIFERATION CELLULAIRE EXTRAFA S C I C U -
LAIRE
Comme dans les faisceaux des fibres musculaires, la proli-
fération cellulaire extrafasciculaire est d’emblée maximale à
J1 et J2 [28 et 33 cellules activées pour 100 fibres muscu-
laires respectivement (Figure 2B)]. Toutefois, elle est moins
importante que la prolifération intrafasciculaire à la même
période. Ensuite, la prolifération cellulaire extrafasciculaire
diminue progressivement jusqu’à J7 où elle atteint 9 cellules
activées pour 100 fibres musculaires. A partir de J14, le
nombre de noyaux cellulaires marqués par le P.C.N.A. /
Cyclin dans les muscles écrasés est identique aux témoins et
reste inférieur à 6 cellules pour 100 fibres (Figure 2B).
Discussion
Le PCNA / Cyclin est une protéine nucléaire acide de 36
kD hautement conservée au cours de l’évolution et qui parti-
cipe à la régulation du cycle cellulaire. C’est une protéine
auxiliaire de l’ADN polymérase δ[4, 13, 17]. Elle est syn-
thétisée à la fin de la phase G1 et durant la phase S du cycle
cellulaire [4, 17].
Différentes études ont montré que le PCNA / Cyclin est un
bon marqueur de l’état de prolifération cellulaire [5].
GALAND et DEGRAEF [8] ont montré, par ailleurs que le
PCNA / Cyclin est une méthode de marquage des noyaux
durant la phase S du cycle cellulaire, capable de se substituer
à la technique usuelle de marquage par autoradiographie à la
thymidine tritiée [12].
Par rapport à cette technique certains auteurs comme
SOMMER et KRESSIN [23] préfèrent la technique de mar-
quage par le MIB-1, un anticorps dirigé contre la protéine
nucléaire associée non - histone humaine Ki-67, qui s’ex-
prime exclusivement durant la phase S du cycle cellulaire. Ils
reprochent en outre à la méthode de marquage au PCNA /
Cyclin d’être peu spécifique de la prolifération cellulaire et
de présenter un bruit de fond important.
Dans l’optique d’un marquage plus précis de la proliféra-
tion cellulaire, nous aurions pu utiliser la bromodéoxyuridine
(BrdU), un analogue de la thymidine qui est incorporée par
les cellules en prolifération uniquement en phase S du cycle
cellulaire [9, 18, 20, 22]. Mais ce marquage implique une
technique plus lourde, difficile à réaliser dans notre labora-
toire.
La plupart des études sur la prolifération cellulaire dans le
muscle strié squelettique rapportent des observations sur
l’état de prolifération des cellules satellites. Le marquage au
PCNA / Cyclin n’est pas spécifique des cellules satellites et a
pour inconvénient de marquer les cellules qui vont se diviser
pendant une longue période du cycle cellulaire, bien au delà
de la phase S. Il répond assez bien à l’objectif principal que
nous nous sommes fixés dans cette étude, celui de juger de
l’état de prolifération cellulaire globale dans le muscle suite à
un traumatisme par écrasement.
Dans un souci de méthodologie, nous avons choisi d’étu-
dier la prolifération cellulaire en deux zones distinctes dans
le muscle. Une zone comprenant les faisceaux des fibres
musculaires (zone intrafasciculaire) et une zone en dehors
des faisceaux des fibres musculaires (zone extrafasciculaire).
Dans notre étude l’évolution temporelle de la prolifération
cellulaire intrafasciculaire est superposable à celle de la pro-
lifération cellulaire extrafasciculaire. Ainsi la prolifération
cellulaire observée dans le muscle tibial crânial (M. tibialis
cranialis) écrasé, est d’emblée maximale à J1 et J2 aussi bien
dans les faisceaux des fibres musculaires (48 et 53 cellules
activées environ pour 100 fibres respectivement à J1 et J2)
qu’en dehors des faisceaux des fibres musculaires (28 et 33
Revue Méd. Vét., 2003, 154, 6, 415-419
PROLIFÉRATION CELLULAIRE DANS LE MUSCLE TIBIAL CRÂNIAL (M. TIBIALIS CRANIALIS) ÉCRASÉ DE RAT 417
FIGURE 1. — Prolifération cellulaire dans le muscle tibial crânial (M. tibialis cranialis) (TC) de rat 2 jours après traumatisme par écrasement musculaire. Les
noyaux marqués par le PCNA / Cyclin sont colorés en brun (flèches). A : Prolifération cellulaire intrafasciculaire, B : Prolifération cellulaire extrafasciculaire.
FM : fibre musculaire; TA : tissu adipeux ; N : nerf.

cellules activées environ pour 100 fibres respectivement à J1
et J2). Ensuite elle diminue graduellement pour atteindre, à
J7, environ 10 cellules activées pour 100 fibres musculaires
aussi bien en zone intrafasciculaire qu’en zone extrafascicu-
laire. A partir de J14 le nombre des cellules activées obser-
vées en zone extrafasciculaire dans les muscles écrasés est
très faible et identique à celui des muscles témoins. En zone
intrafasciculaire la baisse de la prolifération cellulaire obser-
vée se poursuit dans les muscles écrasés pour atteindre à J28,
1 cellule activée pour 100 fibres musculaires. Le niveau de
prolifération est identique à celui observé dans les muscles
témoins.
Il est admis que l’évolution temporelle de la prolifération
cellulaire dans les muscles lésés se présente sous la forme
d’une courbe de GAUSS, avec un recrutement progressif des
cellules activées, un maximum, suivi d’une décrue du
nombre de cellules activées. Ainsi, après incorporation de la
broméodéoxyuridine (BrdU), SAITO et NONAKA [20] ont
observé une prolifération des cellules satellites à partir de 25
heures après l’injection de la bupivacaïne dans le muscle
soléaire (M. soleus) chez les rats Wi s t a r. Le nombre de cel-
lules satellites activées augmente pour atteindre son maxi-
mum à 49 heures, puis diminue à J3 pour s’annuler à 5 jours
après le traumatisme.
L’initiation de la synthèse d’ADN, dans les précurseurs
myogéniques du muscle long extenseur des doigts (M. exten -
sor digitorum longus) autotransplanté chez la souris de
souche BALB/c, débute à 48 heures après l’opération. La
prolifération atteint son maximum à 6 jours et s’achève à 9
jours après l’autotransplantation [19].
Le fait que l’évolution temporelle de la prolifération cellu-
laire dans notre étude commence d’emblée par un maximum
(J1 et J2), pourrait faire croire que le temps d’initiation de la
prolifération cellulaire dans notre modèle expérimental est
inférieur à 24 heures. Il serait judicieux de vérifier cette
hypothèse en réalisant des prélèvements plus précoces (entre
0 et 24 heures après le traumatisme). Toutefois, le temps
d’initiation de la prolifération cellulaire dans notre étude est
similaire à ceux rapportés par d’autres auteurs ayant travaillé
sur un modèle expérimental semblable au nôtre [11, 15].
Ainsi, grâce à la technique d’incorporation de la thymidine
tritiée, ces auteurs ont montré que la synthèse de l’ADN dans
les cellules précurseurs du muscle débute à partir de 24
heures dans le muscle tibial crânial (M. tibialis cranialis)
écrasé de la souris de souche Swiss [15]. Par contre, dans le
muscle tibial crânial (M. tibialis cranialis) écrasé de la souris
de souche BALB/c, GROUNDS et McGEACHIE [11] rap-
portent un temps d’initiation de la prolifération des cellules
satellites de 30 heures.
Le temps d’initiation de la prolifération de cellules satel-
lites semble différer d’un muscle à l’autre et d’une espèce à
l’autre, mais aussi selon la nature du traumatisme ou de
l’agent traumatisant. En effet, SCHULTZ et Coll. [21] rap-
portent un temps d’initiation de la synthèse d’ADN dans les
cellules satellites dans le muscle long extenseur des doigts
(M. extensor digitorum longus) écrasé de rat de souche
Sprague-Dawley de 15, 20 et 25 heures après le traumatisme
au centre, dans les portions moyenne et distale de la lésion
respectivement. RANTANEN et Coll. [18] ont mis en évi-
dence la prolifération des cellules satellites par la technique
d’incorporation à la bromodéoxyuridine (BrdU), 24 heures
après des lésions de contusion ou de toxicité sur des muscles
de rat.
D’autres auteurs rapportent des temps d’initiation de la
prolifération cellulaire plus courts que celui observé dans
notre étude. Par exemple, SNOW [22] observe des noyaux de
cellules satellites marqués par l’incorporation de broméo-
déoxyuridine (BrdU) dès 8 à 16 heures après une lésion
d’émincement de muscles de rats. Dans les cultures de fibre
musculaire isolée exposée aux mitogènes, le temps d’initia-
tion de la synthèse d’ADN par les cellules satellites est de 18
heures [2, 3].
En résumé, le temps d’initiation de la prolifération cellu-
laire est très variable suivant le modèle expérimental et se
situe entre 8 heures (modèle d’émincissement) et 48 heures
(modèle d’autotransplantation). Le temps d’initiation dans
notre étude (24 heures) est très proche du temps d’initiation
moyen (28 heures). Ce temps moyen est assez proche de
celui du modèle de myonécrose par la bupivacaïne (25
heures, [20]). Selon SAITO et NONAKA [20], le temps
d’initiation de la prolifération des cellules satellites pourrait
Revue Méd. Vét., 2003, 154, 6, 415-419
418 BAKOU (S.) ET COLLABORATEURS
FIGURE 2. — Prolifération cellulaire dans le muscle tibial crânial (M. tibialis
cranialis) (TC) de rat après traumatisme par écrasement musculaire
* : Différence significative entre les muscles lésés et témoins.

Revue Méd. Vét., 2003, 154, 6, 415-419
PROLIFÉRATION CELLULAIRE DANS LE MUSCLE TIBIAL CRÂNIAL (M. TIBIALIS CRANIALIS) ÉCRASÉ DE RAT 419
dépendre de l’état de survie des cellules satellites. En outre,
d’après ces auteurs l’invasion de la lésion par des macro-
phages serait un facteur déterminant dans l’activation des
cellules satellites, bien qu’il ait d’autres facteurs qui pour-
raient participer à l’activation des cellules satellites. Les sti-
muli de l’entrée en prolifération des cellules satellites sont
très nombreux dans le muscle écrasé du fait de la présence de
cellules inflammatoires, principalement les macrophages.
Les fibres nécrosées, les cellules endothéliales et les pla-
quettes sanguines peuvent libérer de nombreux facteurs de
croissance qui sont à l’origine de la stimulation des cellules
satellites [3, 10].
Enfin, dans notre étude, le nombre de cellules activées est
plus important dans la zone intrafasciculaire que dans la zone
extrafasciculaire. De plus, la prolifération cellulaire intrafas-
ciculaire s’étend jusqu’à J21, tandis que la prolifération cel-
lulaire extrafasciculaire dans les muscles écrasés n’est plus
significativement différente de celle des muscles témoins à
partir de J14. Le fait que la zone extrafasciculaire soit consti-
tuée de cellules appartenant à différents tissus tels le tissu
conjonctif lâche (fibroblastes, macrophages, granulocytes
neutrophiles, mastocytes...), les vaisseaux sanguins (cellules
endothéliales) et les formations nerveuses (cellules de
Schwann) et que la zone intrafasciculaire en plus des cellules
citées précédemment, soit constituée des cellules du tissu
musculaire (cellules musculaires et cellules satellites) pour-
rait expliquer les différences observées, dans notre étude. De
plus, les processus nécrotiques et inflammatoires sont plus
intenses dans la zone intrafasciculaire.
Conclusions
Notre étude montre que les proliférations intrafasciculaire
et extrafasciculaire sont différentes dans le muscle tibial crâ-
nial (M. tibialis cranialis) écrasé de rat. Cette différence de
réponse pourrait être liée à plusieurs facteurs (cytokines,
composition cellulaire...). Au sein des différentes cellules
rencontrées dans le muscle, quelles sont celles qui participent
réellement à la prolifération cellulaire après écrasement ?
Quelles sont les interactions qui existent entre ces différentes
cellules ? Enfin, quel est le devenir de ces cellules activées ?
Autant de questions posées que certainement l’analyse de
notre modèle expérimental pourrait permettre de com-
prendre.
Remerciements
Les auteurs remercient le Professeur M. WYERS et les
membres de l’UMR/INRA 703 « Développement et patholo-
gie du tissu musculaire « de l’Ecole Nationale Vétérinaire de
Nantes pour leur assistance technique.
Bibliographie
1.—ALLBROOK D.B. : Skeletal muscle regeneration. Muscle Nerv e,
1981, 4, 234-245.
2.—BISCHOFF R. : Proliferation of muscle satellite cells on intact myo-
fibers in culture. Dev. Biol., 1986, 115, 129-139.
3.—BISCHOFF R. : A satellite cell mitogen from crushed adult muscle.
Dev Biol., 1986, 115, 140-147.
4.—B R AVO R., FRANK R., BLUNDELL P.A., McDONALD-BRAV O
H. : Is the auxiliary protein of DNA polymerase δ.Nature, 1987, 326,
515.
5.—BRAVO R., McDONALD-BRAVO H. : Changes in the nuclear dis-
tribution of cyclin (PCNA) but not its synthesis depend on DNA
replication. EMBO J, 1985, 4, 655.
6.—CARLSON B.M. : The regeneration of skeletal muscle: a review. Am.
J. of Pathol., 1973, 137, 119-149.
7.—CARLSON B.M., FAULKNER J.A. : The regeneration of skeletal
muscle fibers following injury: a review. Med. Sci. in Sports and
Exerc., 1983, 15, 187-198.
8.— GALAND P., DEGRAEF C. : Cyclin/PCNA immunostaining as an
alternative to tritiated thymidine pulse labelling for marking S phase
cells in paraffin sections from animal and human tissues. Cell Tissue
Kinetics, 1989, 22, 383-392.
9.—G R ATZNER H.G. : Monoclonal antibody to 5-bromo- and 5-iodo-
deoxyuridine : a new reagent for detection of DNA replication.
Science, 1982, 218, 474-475.
10.—GROUNDS M.D. : Towards understanding skeletal muscle regenera-
tion. Pathol. Res. Pract., 1991, 187, 1-22.
11.—GROUNDS M.D., McGEACHIE J.K. : A comparison of muscle
replication in crush-injured skeletal muscle of Swiss and BALB/c
mice. Cell Tissue Res., 1989, 255, 385-391.
12.—HALL P.A., WOODS A.L. : Immunohistochemical markers of cellu-
lar proliferation: achievements, problems and prospects. Cell Tissue
Kinet, 1990, 23, 505-522.
1 3.— M ATHEWS M.B., BERNSTEIN R.M., ROBERT B.F. Jr., GAR-
RELS J.I. : Identity of proliferating cell nuclear antigen and cyclin.
Nature, 1984, 309, 374-376.
1 4.— MAURO A. : Satellite cell of skeletal muscles fibers. J. Biophys
Biochem. Cytol., 1961, 9, 493-495.
1 5.— McGEACHIE J.K., GROUNDS M.D. : Initiation and duration of
muscle precursor replication after mild and severe injury to skeletal
muscle of mice: an autoradiographic study. Cell. Tissue Res., 1987,
248, 125-130.
16.—PLAGHKI L. : Régénération et myogénèse du muscle strié. Journal
de Physiologie, 1985, 80, 51-110.
17.—PRELICH G., CHENG-KEAT T., KOTSURA M., MATHEWS M.B.,
SO A.G., DOWNEY K.M., STILLMAN B. : Functional identity of
proliferating cell nuclear antigen and a DNA polymerase-δauxiliary
protein. J. Neurol Sci., 1987, 41, 207-221.
18.—RANTANEN J., HURME T., LUKKA R., HEINO J., KALIMO H. :
Satellite cell proliferation and the expression of myogenin and des-
min in regenerating skeletal muscle: evidence for two different popu-
lations of satellite cells. Laboratory Investigation, 1995, 72 (3), 341-
347.
19.—ROBERTS P., McGEACHIE J.K., GROUNDS M.D., SMITH E.R. :
The initiation and duration of myogenesis in transplants of intact ske-
letal muscles: an autoradiography study in mice. Anat. Rec., 1989,
224, 1-6.
20.—SAITO Y., NONAKA I. : Initiation of satellite cell replication in bupi-
vacaine-induced myonecrosis. Acta Neuropathol, 1994, 88, 252-257.
2 1.— S C H U LTZ E., JARYSZAK D.L., VALLIERE C.R. : Response of
satellite cells to focal skeletal muscle injury. Muscle Nerve, 1985, 8,
217-222.
2 2.—SNOW M.H. : Myogenic cell formation in regenerating rat skeletal
muscle injured by mincing : an autoradiography study. Anat. Rec.,
1977, 188, 201-218.
23.—SOMMER U., KRESSIN M. : Proliferation in the gastric epithelium
of bovine abomasum during fœtal development as revealed by Ki-67
immunochemistry. Anat. Histol. Embryol., 2001, 30, 169-173.
1
/
5
100%