Relevé de presse

Relevé de presse
Contact:
Sonia Furtado, EMBL Press Officer, Heidelberg, Germany, Tel: +49 6221 387 8263, www.embl.org, [email protected]
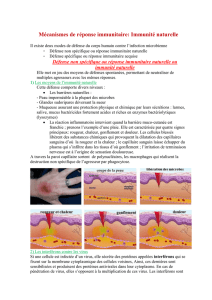
In the absence of viral RNA (left), the part of RIG-I that senses viral
RNA is exposed (orange), whilst the domains responsible for signalling
(blue and pink) are out of reach of the signalling machinery. When
RIG-I detects viral RNA, it changes shape (right), and the signalling
domains become accessible to sound the alarm.
Grenoble, le 14 octobre 2011 – A l’instar d’une chambre-
forte de banque dont l’alarme se déclenche lorsqu’un voleur
tente d’entrer, la cellule possède un système de détection qui
déclenche une alarme immunitaire ultra-rapide en cas d’entrée
d’un microbe. Des chercheurs du Laboratoire Européen
de Biologie Moléculaire (LEBM) de Grenoble, en France,
ont découvert comment la protéine RIG-I, tel un véritable
interrupteur moléculaire, déclenche une réponse immunitaire
dès lors qu’elle détecte une invasion virale. En révélant comment
les cellules répondent à de nombreux virus, dont ceux de la
grippe, de la rage et des hépatites, l’étude publiée aujourd’hui
dans la revue scientifique Cell, fait la lumière sur une étape clé
du fonctionnement du système immunitaire inné.
Les cellules possèdent des récepteurs protéiques capables
de reconnaitre et de se fixer à des motifs moléculaires
caractéristiques d’un intrus infectieux. Cette fixation provoque
à son tour une modification de la forme du récepteur,
déclenchant une réaction en chaîne qui finit par alerter les
cellules voisines de la présence du danger. La connexion
entre la reconnaissance et la signalisation demeurait toutefois
inconnu, jusqu’à ce que les scientifiques du LEBM élucident le
mécanisme structural précis par lequel l’un de ces récepteurs,
appelé RIG-I, convertit un changement de structure en un
signal d’alarme.
‘Pour la biologie structurale, c’est une des questions centrales:
comment la fixation d’un ligand sur son récepteur est-elle
convertie en signal?’ commente Stephen Cusack, qui a dirigé
le projet. ‘Pour répondre à cette question, nous avons choisi
le récepteur RIG-I qui détecte la plupart des virus à ARN,
notamment les virus de la grippe, de la rougeole et de l’hépatite
C.’
Lors d’une infection, RIG-I reconnait le matériel génétique des
virus - en particulier l’ARN - et commande alors la production
d’interférons, messagers défensifs clés de la lutte contre les
virus, à la cellule. Les interférons sont ensuite détectés par les
cellules voisines, où des centaines de gènes impliqués dans la
lutte contre l’infection sont alors activés. Afin de comprendre
comment RIG-I ne reconnait que l’ARN viral et transmet le
signal d’alarme, les scientifiques ont déterminé sa structure
atomique en 3 dimensions en présence et en absence d’ARN,
grâce à une technique de cristallographie utilisant des rayons X
produits par le synchrotron grenoblois (European Synchrotron
Radiation Facility – ESRF). Ils ont découvert qu’en l’absence
d’ARN viral, le récepteur ‘ne dort que d’un œil’, en exposant
son domaine de reconnaissance de l’ARN viral, tandis que les
domaines impliqués dans la transmission du signal restent
inaccessibles pour ‘les messagers’ du système d’alerte. Lorsque
RIG-I détecte la présence d’ARN viral, il se ‘réveille’ en
changeant de forme pour dévoiler ses domaines de signalisation
qui recrutent les ‘messagers d’alertes’ permettant d’activer en
cascade la production d’interférons. Les scientifiques du LEBM
ont identifié le fonctionnement du commutateur moléculaire
RIG-I du canard, mais son fonctionnement est identique chez
l’homme.
‘RIG-I est activé à la présence d’ARN viral, mais d’autres
récepteurs du système immunitaire chargés de détecter
les intrusions par des virus ou des bactéries fonctionnent
probablement de la même manière,’ ajoute Eva Kowalinski,
étudiante en thèse, contributrice d’une grande partie des
travaux de recherche.
Ces résultats contribuent donc à accroître notre connaissance
globale des mécanismes de déclenchement du système
immunitaire inné qui constitue la première ligne de défense
contre les infections, et qui vient d’être reconnue par le prix
Nobel 2011 de physiologie ou médecine.
Ce travail a été mené dans le cadre de l’Unité Mixte Internationale
des Interactions entre Virus et Cellule Hôte (UVHCI), une
collaboration entre le LEBM, l’Université Joseph Fourier (UJF)
de Grenoble et le Centre National de la Recherche Scientifique
(CNRS) et a également bénéficié de contributions du groupe
de Denis Gerlier du département de Virologie Humaine
à l’Institut National de la Santé et de la Recherche Médicale
(INSERM) et à l’Ecole Normale Supérieure de Lyon, France.
Alerte à l’intrus: sonnez l’alarme !
Comment un interrupteur moléculaire active le système immunitaire inné
© EMBL/ Cusack
Article
Kowalinski, E., Lunardi, T., McCarthy, A.A., Louber, J., Brunel, J., Grigorov, B., Gerlier, D. & Cusack, S. Structural basis for the activation
of innate immune pattern recognition receptor RIG-I by viral RNA. Cell, 14 October 2011. DOI: 10.1016/

Informations pour l’utilisation
Les relevés de presse et de photo du LEBM sont protégés par les droits d’auteur. Il est permis de les imprimer gratuitement et de les distribuer pour l’utilisation non-commerciale par la presse
écrite, la radio et la télévision ainsi que par les médias électroniques, à condition que des références claires soient faites concernant les auteurs, les photographes et les créateurs. Des copies
des photos en haute résolution sont disponibles sur le site web du LEBM au www.embl.org.
Au sujet du LEBM
Le Laboratoire Européen de Biologie Moléculaire est un institut de recherche fondamentale nancé par 20 pays membres (l’Allemagne,
l’Autriche, la Belgique, la Croatie, le Danemark, l’Espagne, la Finlande, la France, la Grèce, l’Irlande, l’Islande, Israël, l’Italie, le Luxembourg,
la Norvège, les Pays-Bas, le Portugal, le Royaume-Uni, la Suède et la Suisse) et un membre associé l’Australie. La recherche au LEBM est
menée par quelque 85 groupes indépendants qui couvrent tout le champ de la biologie moléculaire. Le laboratoire est géographiquement
réparti de la façon suivante : le siège se situe à Heidelberg, et il y a quatre antennes, une à Hinxton (le Laboratoire Européen pour
la Bio-informatique), une à Grenoble, une à Hambourg et une à Monterotondo près de Rome. La mission du LEBM est diversiée :
recherche fondamentale en biologie moléculaire ; formation des scientiques, étudiants et visiteurs quel que soit leur niveau ; service
aux chercheurs des pays membres ; développement de nouveaux instruments et de nouvelles méthodes dans le domaine des sciences du
vivant ainsi que transfert de technologie. Le Programme International d’Études Doctorales du LEBM accueille environ 190 étudiants.
Enn, le laboratoire ore une plateforme de dialogue avec le public grâce à des activités de communication scientiques telles que des
séries de conférences, les programmes de visiteurs et la diusion des réussites scientiques.
1
/
2
100%