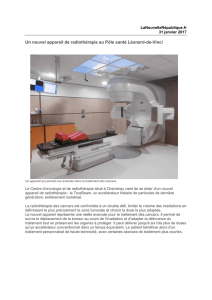
Les séquelles cérébrales à long terme de la radiothérapie

La toxicité tardive de
la radiothérapie chez
l’enfant
Dr. Dinu STEFAN
Pr. Jean-Louis HABRAND

Survie des tumeurs de l’enfant
Evolution sur 20 ans
80.4
80.4
1.4 % / Year
1.4 % / Year
Increase in Cure Rate (Survival Plateau)
has been Steady and Linear
60
60
70
70
80
80
1975
1975 1985
1985 1995
1995
%
%
Cure
Cure
50
50
C C G
C C G
Bleyer
Bleyer
Ries LAG, Smith MA, Gurney JG et al. Cancer Incidence and Survival Among Children
and Adolescents: United States, SEER Program, 1975-1995. National Institute of Health
Pub. No. 99-4649. Bethesda, MD, 1999
Survie très faible des
patients avant 1970
Amélioration significative
dans les 40 derniers
années.
La survie globale est
montée à 75-80% après
1990

Prise en charge thérapeutique
des tumeurs de l’enfant
Traitement multi modal
Chirurgie
Chimiothérapie
Radiothérapie
Chimiothérapie haute dose avec greffe
Immunothérapie et thérapies ciblées
Traitement de support

Objectifs de la
radiothérapie
Guérir…
…sans séquelles
Un rève ?
"I Have a Dream"

Toxicité tardive. Généralités.
70% des survivants présentent au mois une
toxicité tardive
25% ont une déficit sévère
Les toxicités peuvent se manifester dés
l’enfance ou plus tard à l’âge adulte
Manifestations cliniques bruyantes ou évolution
insidieuse
Les manifestations cliniques peuvent être
exacerbées par d’autres maladies survenues
tardivement.
Impact significatif sur la qualité de vie des
survivants.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
1
/
30
100%