au niveau de la jonction neuromusculaire - AFM

JOURNÉES DES FAMILLES 2013
terminaison
nerveuse (axonale)
vésicule synaptique
contenant
le neurotransmetteur
lame basale
cellule musculaire
repli
post-synaptique
noyau
mitochondrie
acétylcholine
acétylcholinestérase
MuSK
Dok-7
ChAT
fente synaptique
(ColQ)
rapsyne
récepteur de
acétylcholine
l'
laminine β2
cellules
de Schwann
bouton pré-synaptique
1
1
4
4
2
2
3
3
5
5
5’
5’
myasthenie-auto-immune.afm-telethon.fr
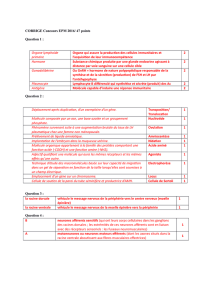
1 : Dans l’élément pré-synaptique (terminaison axonale du
neurone), le neurotransmetteur acétylcholine est stocké
dans des vésicules synaptiques.
2 : L’arrivée de l’infl ux nerveux à la terminaison nerveuse
entraîne la fusion des vésicules avec la membrane pré-
synaptique.
3 : Les vésicules libèrent l’acétylcholine dans la fente
synaptique.
4 : Les molécules d’acétylcholine libérées vont se fi xer sur
la membrane post-synaptique (de la cellule musculaire) au
niveau des récepteurs de l’acétylcholine.
5 : Cette fi xation entraîne un passage d’ions à travers
la membrane de la fi bre musculaire, qui aboutit à la
contraction de la fi bre musculaire.
5’ : Dans le même temps, les molécules d’acétylcholine
présentes dans la fente synaptique sont soit recaptées
par la membrane pré-synaptique, soit détruites par
l’acétylcholinestérase.
La machinerie de la transmission synaptique est alors prête
à un nouveau cycle de transmission synaptique.
Transmission synaptique
au niveau de la jonction neuromusculaire
© AFM-Téléthon - M. Gilles

JOURNÉES DES FAMILLES 2013
Fa i t s m a rq ua n t s
syndrome-myasthenique-congenital.afm-telethon.fr
Syndromes myasthéniques congénitaux ()
>
>
À
À
quoi sont-ils dus ?
quoi sont-ils dus ?
> Fréquence des anomalies génétiques chez
680 personnes atteintes de SMC.
Seulement 44 % des personnes présentaient une anomalie
d'un gène connu.
> Le réseau national français des syndromes
myasthéniques congénitaux a publié son expérience.
• Près de la moitié seulement des 300 personnes suivies par
le réseau français ont un diagnostic génétique moléculaire
précisé.
• Les gènes CHNRE, RAPSN, COLQ et DOK7 sont les plus
fréquemment impliqués dans les SMC.
> Identifi cation de 3 nouveaux gènes.
Les gènes DPAGT1, ALG2 et ALG14 interviennent dans la
glycosylation de certaines protéines.
> La diminution des récepteurs de l’acétylcholine
à la surface de la membrane pourrait être due à un défaut
dans leur glycosylation lié notamment aux mutations dans les
gènes GFPT1 ou DPAGT1.
> Effi cacité de l'albutérol
• Confi rmée chez 9 enfants atteints de SMC lié à DOK7
et traités pendant 28 mois.
• Essai de phase II en ouvert de l’albutérol en cours
aux États-Unis chez 50 personnes atteintes de
syndrome myasthénique congénital avec un défi cit en
acétylcholinesterase (AChE) ou en Dok-7.
terminaison
axonale
musculaire
MuSK
Dok-7
ChAT
rapsyne
laminine β2
acétylcholine
acétyl-
cholinestérase
(ColQ)
récepteur de
l'acétylcholine
cellule
fente
synaptique
© AFM-Téléthon - M. Gilles
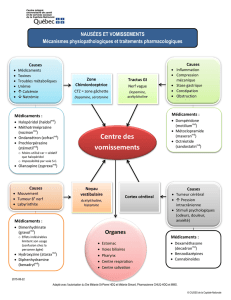
> SMC post-synaptiques
• Perte des récepteurs de l'acétylcholine (RACh) -> Mutations des gènes des sous-unités (α, β, γ, δ, ε) de RACh.
• Anomalies d'ouverture des RACh (canal lent, canal rapide) -> Mutations des gènes des sous-unités (α, β, γ, δ, ε) de RACh.
• Mutations du gène RAPSN codant la rapsyne, protéine associée aux RACh.
• Mutations du gène SCN4A codant un canal sodium Nav1.4.
• Mutations du gène de la plectine, une protéine liant les composants de la cellule à la membrane.
• Mutations dans le gène codant la protéine MuSK nécessaire à l’agrégation des RACh à la membrane musculaire sous l’action de l’agrine
neuronale.
• Mutations du gène codant la protéine Dok-7, interagissant avec MuSK et responsable de certaines myasthénies des ceintures.
• Mutation du gène DPAGT1 qui code une protéine impliquée dans la glycosylation.
• Mutation des gènes ALG2 et ALG14 qui codent des protéines impliquées dans la glycosylation.
> SMC synaptiques
• Défi cit en acétylcholinestérase (AChE),
enzyme responsable de la destruction de
l’ACh.
-> Mutations du gène COLQ codant le
collagène Q, protéine de liaison entre
l’AChE et la lame basale synaptique.
• Défi cit en laminine bêta2, chaîne bêta de la
laminine 2, composant essentiel de la lame
basale synaptique.
-> Mutations du gène LAMB2 codant la
laminine bêta 2.
• Défi cit en agrine, présente notamment au
niveau de la jonction neuromusculaire.
-> Mutations du gène AGRN codant
l’agrine.
> SMC pré-synaptiques
• Défauts dans la production ou le stockage
de l’acétylcholine (ACh).
-> Mutations du gène CHAT codant
la choline acétyltransférase, enzyme
nécessaire à la synthèse de l’acétylcholine.
• Mutation du gène codant la protéine GFPT1, responsable de certains SMC (localisation encore mal connue).
1
/
2
100%