Hémi-synthèse Aspirine : TP Chimie Terminale S

Terminale S www.sciencesphysiques.info
TP de Sciences Physiques n°23 : hémi synthèse de l’aspirine Page 1 / 2
TP de Sciences Physiques nÀ23
Hémi synthèse de lÊaspirine
Réaction
d’estérification
à partir d’un anhydride d’acide
Objectifs de la séance
Etudier et analyser un protocole de synthèse organique.
Différencier « synthèse » et « hémi synthèse », ou « matière première naturelle » et « réactif élaboré ».
Suivre un protocole expérimental en respectant des normes de sécurité.
Connaître les différentes étapes d’un protocole : préparation, transformation, traitement, purification,
identification.
Compétences mises en jeu
Analyser (le protocole et l’intérêt des différentes étapes), réaliser (le mettre en œuvre) et valider (étapes de
purification et d’identification).
Définition de l’hémi synthèse
Une « synthèse » est la préparation d’un produit à partir de matières premières naturelles.
Une « hémi synthèse » est la préparation d’un produit à partir de réactifs déjà élaborés.
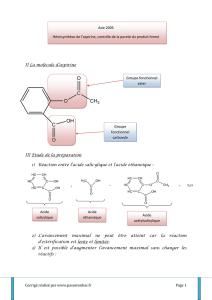
Présentation de l’aspirine
L’aspirine est le nom commun de l’acide acétylsalicylique. Comme ce nom l’indique, l’aspirine est donc un
acide au sens de Brönsted, ce qui nous a permis de faire son titrage pHmétrique la semaine dernière, mais
l’aspirine présente aussi un groupe « ester ».
O fonction « ester »
//
CH
3
– C
\ caractère « acide »
O – C
6
H
4
– COOH
Cet ester peut être préparé à partir d’un anhydride d’acide : l’anhydride acétique (ou éthanoïque). Ce réactif
ne se rencontre pas à l’état naturel et nécessite donc d’être préparé en laboratoire. Il est fortement réactif avec
l’eau et doit être tenu à l’écart de toute humidité. L’acétylation de la fonction phénol de l’acide salicylique
par action de l’anhydride éthanoïque constitue donc une « hémi synthèse » de l’aspirine.
O
//
CH
3
– CO – O – CO – CH
3
+ OH – C
6
H
4
– COOH = CH
3
– C + CH
3
– COOH
\
O – C
6
H
4
– COOH
L’aspirine ainsi préparé est le médicament le plus consommé au monde.
Sécurité
Les anhydrides d’acide constituent une famille de composés organiques corrosifs et lacrymogènes. Ils ne
doivent pas entrer en contact avec de l’eau. Ils permettent, par réaction avec un alcool, de préparer des esters.
L’anhydride acétique devra donc être manipulé sous la hotte avec gants et lunettes.

Terminale S www.sciencesphysiques.info
TP de Sciences Physiques n°23 : hémi synthèse de l’aspirine Page 2 / 2
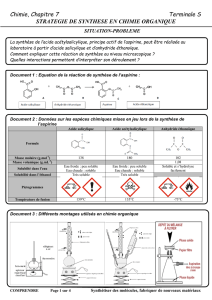
Données physiques sur les réactifs
Réactif ou produit Masse molaire Densité Masse / Volume T°C de fusion
Acide salicylique M = 138 g.mol
-1
1,443 5,00 g 159°C
Anhydride éthanoïque M = 102 g.mol
-1
1,082 7 mL - 73°C
Acide acétylsalicylique M = 180 g.mol
-1
N.C N.C 135°C
L’anhydride éthanoïque est corrosif et lacrymogène.
L’acide salicylique est nocif.
L’acide sulfurique concentré est très corrosif et réagit violemment avec l’eau.
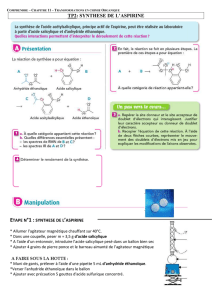
Hémi synthèse de la molécule d’aspirine : fabriquer la molécule d’acide acétylsalicylique
Mets dans un ballon monocol, avec précaution et sous la hotte, 5,0 g d’acide salicylique, 7,0 mL
d’anhydride éthanoïque, et 3 gouttes d’acide sulfurique concentré.
Homogénéise le mélange en agitant avec une tige en verre et mets de la pierre ponce dans le ballon.
Adapte un réfrigérant à eau sur le ballon et chauffe à 70°C pendant 20 minutes.
Refroidis à température ambiante en agitant un peu le ballon.
Verse doucement et sous agitation le contenu du ballon dans 50 mL d’eau distillée glacée (bécher).
Attends la cristallisation. Place le bécher dans un bain de glace si nécessaire et gratte le fond.
Lavage : éliminer les produits en excès
Filtre le précipité obtenu sur Büchner.
Ajoute de l’eau distillée froide et fais-la pénétrer dans tout le précipité.
Filtre à nouveau.
Recommence plusieurs fois la même opération puis récupère l’aspirine synthétisée.
Purification par recristallisation
Cette étape consiste à dissoudre le produit formé dans un minimum de solvant à chaud puis le recristalliser
à température ambiante et enfin dans la glace. Les impuretés restent dans la solution.
A l’aide d’un montage à reflux, fais chauffer l’aspirine dans un mélange « eau + éthanol ».
Refroidis ensuite le mélange : il apparait des paillettes par recristallisation.
Filtre sur Büchner, puis récupère et sèche l’aspirine obtenue.
Identification par mesure de température de fusion
On dispose d’un banc Kofler. C’est une table chauffante présentant un gradient de température et
permettant d’estimer la température de fusion d’un solide.
Après séchage (éventuellement terminé à l’étuve), place un échantillon de l’aspirine obtenue sur la
partie froide du banc Kofler.
Déplace lentement l’échantillon vers sa partie chaude jusqu’à observer sa fusion et note la température
correspondante.
Un composé est considéré comme impur, quand sa température est inférieure à la température attendue, ou
quand sa fusion s’effectue sur une plage de température et non à une température précise.
Compte-rendu
Rédige un compte-rendu précis et pertinent sur la l’hémi synthèse de l’aspirine, en détaillant, expliquant et
schématisant si nécessaire chaque étape du protocole.
1
/
2
100%